 |
Структура гликозаминогликанов
|
|
|
|
| Гликозами-ногликаны | Уроновая кислота | Галак- тоза | Гексоз- амин | Дисахаридная единица |
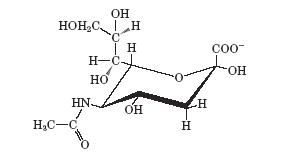
| Гиалуроновая кислота | D-глюку роновая кислота Glc A | N-ацетил-D-глюко- замин GlcNAc | 
| |
| Хондрои- тинсуль- фаты | D-глюку роновая кислота Glc A | N-ацетил-D-галак- тозамин GalNAc | 
| |
| Кератан- сульфат | галак- тоза Gal | N-ацетил- D-глюко- замин GlcNAc | 
| |
| Дерматан- сульфат | D-глюку-роновая кислота Glc A, L-идуро- новая кислота Ido A | N-ацетил-D-глюко- замин GlcNAc |

| |
| Гепаран- сульфат/ Гепарин | D-глюку-роновая кислота Glc A, L-идуро- новая кислота Ido A | N-ацетил- D-глюко- замин GlcNAc | 
|
льной ткани с помощью двух связывающих белков прочно агрегируют с гиалуроновой кислотой в большие конгломераты. Хондроитинсульфатные цепи содержат следующие протеогликаны: агрекан, нейрокан, бревикан, бамакан, синдеканы, пентагликан, серглицин, некоторые из них модифицированы также гепарансульфатными и кератансульфатными цепями.
Кератансульфаты, чрезвычайно гетерогенные гликозаминогликаны, отличаются по содержанию углеводов и распределению в разных тканях. Они состоят из повторяющихся дисахаридных единиц, в состав которых входит остаток галактозы и остаток N-ацетил-D-глюкозамина, сульфатированного по шестому положению. Кератансульфат I, обнаруженный в роговице глаза, кроме дисахаридной единицы, содержит L-фукозу, D-маннозу и сиаловую кислоту. В состав кератансульфата II, находящегося в хрящевой ткани, костях, межпозвоночных дисках, входят также L-фукоза, D-манноза, сиаловая кислота и N-ацетил-D-галактозамин. Кератансульфаты в отличие от других гликозаминогликанов не содержат остатка уроновой кислоты, вместо нее в них присутствует остаток галактозы. Молекулярная масса одной цепи кератансульфата 4 000-20 000 D. N-связан- ные с коровым белком кератансульфатные цепи типа I содержат люмикан, кератокан, остеоглицин, фибромодулин, остеоадгерин. О-связанные кератансульфатные цкпи типа II обнаружены в
|
|
|
Дерматансульфат, найденный в коже, кровеносных сосудах, сердечных клапанах и входящий в состав малых протеогликанов (бигликана, версикана, эндокана и декорина), имеет повторяющейся дисахаридной единицей структуру, состоящую из остатка идуроновой кислоты и остатка N-ацетил-D-галактозамин-4-сульфата. Отличие от хондроитинсульфата заключается в том, что вместо глюкуроновой кислоты, соединенной с N-ацетил-D-галактозамином b1®3 гликозидной связью, дерматансульфат содержит остаток идуроновой кислоты, соединенной с N-ацетил-D-галактозамином a1®3 гликозидной связью. В дерматансульфате два вида дисахаридных единиц: идуроновая кислота - N-ацетил-D-галактозамин и глюкуроновая кислота - N-ацетил-D-галактозамин. Первоначально все остатки уроновой кислоты представлены глюкуроновой кислотой, но после образования полисахарида большее количество остатков глюкуроновой кислоты превращается в идуроновую под действием 5-эпиме- разы уроновых кислот. Образовавшаяся идуроновая кислота подвергается О-сульфированию по второму положению, при этом реакция эпимеризации тесно сопряжена с сульфированием гексозамина. Молекулярная масса одной цепи дерматансульфата 15 000-40 000 D.
Гепарин, один из главных компонентов противосвертывающей системы крови (на рис. 3.12 представлена пентауглеводная последовательность в гепарине, связывающая антитромбин III, инактивирующий сериновые протеазы системы свертывания крови), синтезируется в тучных клетках, локализован внутриклеточно и обнаруживается также в легких, печени и коже. Повторяющаяся дисахаридная единица содержит остаток уроновой кислоты и остаток N-ацетил-D-глюкозамина, большей частью N-сульфированного, но имеется небольшое количество ацетилированных аминогрупп. Остаток глюкуроновой кислоты частично сульфирован по второму положению. Молекулярная масса гепарина 6 000-25 000 D.
|
|
|

Рис. 3.12. Пентауглеводная последовательность в гепарине, ответственная за связывание антитромбина III, являющегося членом семейства серпинов (ser ine p rotease in hibitor) - ингибиторов сериновых протеаз. Для свертывающей системы крови необходимо наличие 3-О-сульфированного остатка в N-ацетил-D-глюкозамине
Гепарансульфат, постоянный компонент клеточной поверхности, имеет структуру дисахаридной единицы такую же, как и гепарин. Отличие этих гликозаминогликанов друг от друга заключается в том, что в гепарине больше N-сульфированных аминогрупп, а в гепарансульфате преобладают N-ацетильные. Молекулярная масса гепарансульфата 5 000-12 000 D. Гепарансульфат содержит меньшее количество идуроновой кислоты, в нем преобладает глюкуроновая кислота, а в гепарине - идуроновая.
Гепарансульфат играет существенную роль в регуляции воспалительных процессов, в росте и дифференцировке клеток, транспорте и выведении липидов, во взаимодействии клеток между собой и с поверхностью матрикса. Ассоциация гепарансульфата с хемокинанами стабилизирует концетрационные градиенты этих соединений через поверхность эндотелия, что приводит к направленной миграции лейкоцитов в место воспаления (например, при атеросклерозе или артрите). Гепарансульфаты защищают хемокины от протеолитической деградации и, вызывая их олигомеризацию, повышают локальную концентрацию хемокинов, приводя к взаимодействию с рецепторами и дальнейшеему прохождению сигнала о воспалении в клетку. К гепарансульфатным протеогликанам, локализованным на клеточной поверхности, относят семейства глипиканов и синдеканов, бетагликан.
3.3.2. Метаболизм гликозаминогликанов. Превращения гликозаминогликанов зависят от скоростей их синтеза и распада. Полисахаридные цепи гликозаминогликанов связаны с коровым (сердцевинным) белком протеогликанов через связующую область, состоящую, как правило, из трисахарида, имеющего следующий состав: галактоза-галактоза-ксилоза. Известно четыре типа присоединения олигосахаридов к гликопротеинам: 1) с помощью О-гликозидной связи между Ser и ксилозой, О-гликозидной связи между Ser или Thr и N-ацетил-D-галактозамином; 2) N-гликозиламинной связи между амидным азотом Asn и N-ацетил-D-глюкозамином; 3) с помощью гликозилфосфатидилинозитола; 4) с помощью С-гликозилирования остатка триптофана (последний вид связи встречается достаточно редко в некоторых мембранных и секреторных гликопротеинах). В протеогликанах в основном представлены два первых типа связывания полисахаридов с белковой частью.
|
|
|

Синтез гликопротеинов осуществляется в эндоплазматическом ретикулуме и аппарате Гольджи. Моносахаридные предшественники синтезируются на цитоплазматической стороне эндоплазматического ретикулума в результате многочисленных ферментативных реакций и транслоцируются в полость эндоплазматического ретикулума, где происходит сборка полисахаридных цепей последовательным присоединением активированных моносахаридов (UDP-глюкозы, UDP-галактозы, UDP-ацетилглюкозамина и т. д.) с помощью трансфераз, обладающих абсолютной специфичностью в отношении субстрата, т. е. присоединение различных углеводных остатков катализируется отдельным ферментом. Например, в хондроитинсульфатах шесть типов межсахаридных связей, в их синтезе принимает участие шесть типов различных гликозилтрансфераз - по одному ферменту для каждого типа связей. В отличие от N-гликозилирования О-гликозилирование является посттрансляционным процессом. Ферменты, принимающие участие в О-гликозилировании, локализованы на мембранах аппарата Гольджи. К синтезированному на полирибосомах коровому белку, поступившему в аппарат Гольджи по каналам эндоплазматического ретикулума, присоединяются моносахариды связующей области (остаток ксилозы связывается с серином под действием UDP-ксилоза-трансферазы), и на них последовательно наращивается остальная полисахаридная цепь.
N-ацетилнейраминовая (сиаловая) кислота
Рост полисахаридной цепи завершается сиалированием (присоединением ацетилированного остатка нейраминовой, или сиаловой кислоты) специфическими сиалилтрансферазами (эта реакция получила название кэпирование полисахаридной цепи, она необходима для защиты гликопротеина или протеогликана от протеолиза). Увеличение в крови концентрации сиаловых кислот свидетельствует о распаде межклеточного матрикса, что наблюдается при воспалении.
|
|
|
После образования полисахаридной цепи происходят химические модификации в виде включения сульфатных групп и эпимеризации. Сульфирование происходит здесь же с помощью сульфотрансфераз, катализирующих перенос сульфатной группы от 3’-фосфоаденозил-5’-фосфосульфата (ФАФС) на спиртовую или аминогруппу сахара.

3’-фосфоаденозил-5’-фосфосульфат (ФАФС)
Аминосахара (N-ацетил-D-глюкозамин,N-ацетил-D-галактозмин, сиаловая кислота) синтезируются из фруктозо-6-фосфата. Аминогруппа происходит из Gln. Затем образовавшийся аминосахар ацетилируется с помощью ацетил-СоА.


b-D-глюкуроновая кислота b-L-идуроновая кислота
(GlcA) (IdoA)
Глюкуроновая кислота может поставляться с пищей, образовываться при внутриклеточном микросомальном гидролизе гликозаминогликанов или синтезироваться при окислении UDP-глюкозы:
UDP-глюкоза + 2 NAD+ + Н2О ® UDP-глюкуроновая кислота +
+ 2 NADН + 2 Н+.
L-идуроновая кислота образуется после включения D-глюкуроно- вой кислоты в полисахаридную цепь в результате эпимеразной реакции, важную роль в которой играет сульфирование остатков соседнего сахарида.

Рис. 3.13. Схема синтеза гепарина (согласно [8])
Например, синтез гепарина включает в себя следующие стадии:
1) первичный продукт, содержащий только глюкуроновую кислоту, полностью N-ацетилируется;
2) 50 % остатков N-ацетил-D-глюкозамина подвергается N - аце- тилированию;
3) свободные аминогруппы глюкозамина сульфируются;



Рис. 3.14. Схема синтеза гепарансульфатного протеогликана клеточной поверхности. Процесс включает в себя три стадии: 1) инициацию цепи путем последовательного присоединения ксилозы, двух остатков галактозы к остатку серина сердцевинного белка, 2) полимеризацию моносахаридов в след за включением нескольких остатков N-ацетилглюкозамина и 3) модификацию полисахаридной цепи c помощью сульфирования и эпимеризации (согласно [11])
4) дальнейшее деацетилирование остальных групп N-ацетил-D-глюкозамина;
5) 5-эпимераза превращает свой субстрат - N-сульфированный полимер, содержащий глюкуроновую кислоту, в идуроновую кислоту (примерно 90 %);
6) остаток идуроновой кислоты подвергается О-сульфированию во второе положение;
7) реакция завершается О-сульфированием глюкозамино-2-сульфата в шестое положение (рис. 3.13 и 3.14).
|
|
|
В случае гепарансульфата деацетилирование N-ацетил-D-глюкозамина в его полисахаридных цепях происходит слабее, он содержит меньше N-сульфатов. Поскольку субстратом 5-эпимеразы являются только N-сульфатные дисахаридные единицы, гепарансульфат содержит меньше идуроновой кислоты и больше глюкуроновой.

Рис. 3.15. Субстратная специфичность гепаринлиаз, расщепляющих полисахаридную цепь гепарина или гепарансульфата по механизму элиминации, и гепараназы, действующей как гидролаза (согласно [5])
Синтез гиалуроновой кислоты и сульфатированных гликозаминогликанов тормозится глюкокортикоидами, а также половыми гормонами.
Гликозаминогликаны обладают высокой скоростью обмена (полупериод жизни составляет 3-10 дней). Они гидролизуются экзо- и эндогликозидазами и сульфатазами (гиалуронидазой, глюкуронидазой, галактозидазой, идуронидазой и т. д.). На рис. 3.15 представлена субстратная специфичность гепаринлиаз I, II, III (А), катализирующих реацию расщепления углеводной цепи путем элиминации, и гепараназы (В), действующей как гидролаза. Из внеклеточного пространства гликозаминогликаны поступают в клетку путем эндоцитоза, заключаются в эндоцитозные пузырьки, которые сливаются с лизосомами. Лизосомальные гидролазы расщепляют гликозаминогликаны до мономеров.
Наследственные дефекты гидролаз, участвующих в катаболизме гликозаминогликанов, гликопротеинов и протеогликанов, приводят к возникновению тяжелых заболеваний - мукополисахаридозов (как уже упоминалось, ранее протеогликаны носили название «мукополисахариды»). Эти заболевания проявляются в поражениях сосудов, помутнении роговицы, деформации скелета, нарушении умственно-
го развития детей. Для постановки диагноза конкретного заболевания определяют активность лизосомальных гидролаз. В настоящее время эти болезни не поддаются лечению, необходима пренатальная диагностика при подозрении на носительство дефектных генов.
3.3.3. Структура протеогликанов. В межклеточном матриксе протеогликаны и гликозаминогликаны агрегируют с образованием полимерных комплексов очень крупных, характерных для агрекана или версикана, или малых (в случае декорина, бигликана, фибромодулина, перлекана, люмикана). Так, протеогликан хряща агрекан соединяется с гиалуроновой кислотой через связующие белки семейства гиаладгеринов, образуя агрегат, содержащий до 100 молекул агрекана. На рис. 3.16 представлена структура агрегата протеогликана и гликозаминогликана. Видно, что к длинной центральной цепи гиалуроновой кислоты присоединены боковые цепи протеогликанов, представляющие собой комплексы так называемого сердцевинного (корового - «core») белка с более короткими гликозаминогликановыми цепями (хондроитинсульфатными, кератансульфатными или дерматансульфатными). Присоединение происходит нековалентно через связующий белок, реагирующий, с одной стороны, с гиалуроновой кислотой, с другой, с протеогликаном.

Рис. 3.16. Структура агрегата протеогликана с гликозаминогликаном. Агрегат состоит из центральной цепи гиалуроновой кислоты, к которой в виде боковых цепей присоединены протеогликаны, представляющие собой комплекс сердцевинного белка с короткими гликозаминогликанами: хондроитинсульфатами, кератансульфатами, дерматансульфатами. Комплекс сердцевинного белка и коротких гликозаминогликанов присоединен к гиалуроновой кислоте нековалентно с помощью связующего белка (согласно [6])
Молекулярные массы сердцевинных белков варьируют от 10 000 до более 600 000. Данные белки чрезвычайно разнообразны. Не обнаружено каких-либо структурных черт, четко отделяющих сердцевинные белки протеогликанов от других белков: у многих имеются домены, гомологичные доменам других белков внеклеточного матрикса или плазматической мембраны.
Протеогликаны и гликозаминогликаны могут связываться также с фибриллярными белками матрикса (например, протеогликан декорин взаимодействует с коллагеновыми фибриллами) и с белковой сетью внеклеточного матрикса (базальной мембраной).
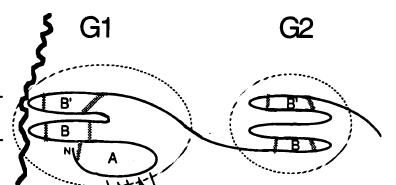
Рис. 3.17. Взаимодействие G1 домена агрекана, содержащего тандемный повтор, с гиалуроновой кислотой. Домен G1 ответственен за взаимодействие с гиалуроновой кислотой, в районе домена G2 присоединяются цепи хондроитинсульфата и кератансульфатов (согласно [7])
Цепи гликозаминогликанов в протеогликанах присоединены к сердцевинному белку. В случае агрекана это длинная полипептидная цепь молекулярной массой 220 кDa, состоящая из трех глобулярных доменов: G1, G2, G3. Из рис. 3.17, на котором изображено взаимодействие агрекана и гиалуроновой кислоты, видно, что каждая молекула агрекана с помощью своего G1 домена, содержащего тандемный повтор, взаимодействует приблизительно с пятью дисахаридными единицами гиалуроновой кислоты. Связывающий белок стабилизирует образовавшийся комплекс, занимая 25 дисахаридных единиц гиалуроновой кислоты. К одной полипептидной цепи сердцевинного белка в районе между доменами G2 и G3 присоединяются до сотни цепей хондроитинсульфатов и до 30 цепей кератансульфатов. Функция домена G2 пока неизвестна. Домен G3 необходим для присоединения агрекана к другим молекулам межклеточного матрикса и участвует в межклеточных взаимодействиях. В местах присоединения гликозаминогликанов имеются пептидные участки длиной 6 и 19 аминокислотных остатков, повторяющиеся 10-20 раз. Агрекан и связывающий белок могут образовать комплекс еще в клетке, а процесс агрегации завершается уже в межклеточном матриксе. Гиалуроновая кислота синтезируется на поверхности хондроцитов и поступает в межклеточное пространство, где и образуется активный тройной комплекс.
В малых протеогликанах сердцевинные (коровые) белки небольшие, содержат несколько тандемных повторов, богатых лейцином, могут образовывать a-спирали и b-структуры, на концах имеются домены, содержащие дисульфидные связи. Сердцевинные белки малых протеогликанов отличаются первичной структурой N-концевых областей, что приводит к разному присоединению к ним цепей гликозаминогликанов. На рис. 3.18 представлено несколько структур малых протеогликанов клеточной поверхности: синдекана, глипикана и перлекана.
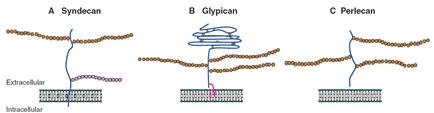

Рис. 3.18. Структура малых протеогликанов клеточной поверхности: А - синдекана, В - глипикана и С - перлекана (согласно [11])
Из рис. 3.18 видно, что синдекан содержит две гепарансульфатные цепи, присоединенные к серину сердцевинного белка (core protein) вдали от клеточной мембраны, и одну хондроитинсульфатную цепь, связанную с серином сердцевинного белка вблизи поверхности клетки. В глипикане глобулярный домен стабилизирован многочисленными дисульфидными связями, а сам протеогликан заякорен на клеточной поверхности с помощью гликозилфосфатидилинозитола (GPI linkage).
Сердцевинный белок малого протеогликана - фибромодулина не содержит в N-концевом домене серина, а имеет несколько сульфатированных остатков тирозина. Присоединение кератансульфатных цепей происходит поэтому в области тандемных повторов, богатой лейцином, через амидную группу аспарагина
Малые протеогликаны являются мультифункциональными соединениями. Образуя комплексы с другими компонентами соединительной ткани, они влияют на их строение и функции. Декорин и фибромодулин, присоединяясь к фибриллам коллагена, ограничивают их диаметр. Присоединение декорина к фактору роста опухолей приводит к уменьшению его активности. Малые протеогликаны также играют важную роль в процессах развития и восстановления соединительной ткани.
Библиографический список
1. Биохимия / Под ред. Е. С. Северина. М.: Гэотар-Мед, 2007.
2. Марри Р., Греннер Д., Мейес П., Родуэл В. Биохимия человека. М.: Мир, 2004. Т. 1-2.
3. Овчинников Ю. А. Биоорганическая химия. М.: Просвещение, 1987.
4. Страйер Л. Биохимия. М.: Мир, 1984. Т. 1-3.
5. Capila I., Linhardt R. J. Heparin - Protein Interactions // Angew. Chem. Int. Ed. 2002. V. 41. P. 390-412.
6. Edavettal S. C., Lee K. A., Negishi M., Linhardt R. J., Liu J., Pederson L. C. Crystal structure and mutational analysis of heparin sulfate 3-O-sulfotransferase isoform 1 // J. Biol. Chem. 2004. V. 279. P. 25789- 25797.
7. Hardingham T. E., Fosang A. J. Proteoglycans: many forms and many functions // FASEB J. 1992. V. 6. P. 861-870.
8. http:// humbio.ru/humbio/cytology
9. Kadler K. E., Holmes D. F., Trotter J. A., Chapman J. A. Collagen fibril formation // Biochem. J. 1996. V. 316. P. 1-11.
10. Kivirikko K. I., Myllyla R., Pihlajaniemi T. Protein hydroxylation: prolyl 4-hydroxylase, an enzyme with four cosubstrates and a multifunctional subunit // FASEB J. 1989. V. 3. P. 1609-1617.
11. Lin X. Functions of heparan sulfate proteoglycans in cell signaling during development // Development. 2004. V. 131. P. 6009-6021.
12. Lucero H. A., Kagan H. M. Lysyl oxidase: an oxisative enzyme and effector of cell function // Cell. Mol. Life Sci. 2006. V. 63. P. 2304- 2316.
13. Myllyharju J. Prolyl 4-hydroxylases, the key enzymes of collagen biosynthesis // Matrix Biology. 2003. V. 22. P. 15-24.
14. Myllyharju J., Kivirikko K. I. Collagens, modifying enzymes and their mutations in humans, flies and worms // Trends Genet. 2004. V. 20. P. 33-43.
15. Nelson D. L., Cox M. M. Lehninger Principles of Biochemistry. 4th e. New York: W. H. Freeman, 2004.
16. Reiser K., Mc Cormick R. J., Rucker R. B. Enzymatic and nonenzymatic cross-linking of collagen and elastin // FASEB J. 1992. V. 6. P. 2439-2449.
Оглавление
| Часть 1. Биохимия дыхания……………………………… | |
| Глава 1.1. Кислород-переносящие белки…………………………. | |
| 1.1.1. Простетическая группа миоглобина и гемогло- бина - гем…………………………………………………… | |
| 1.1.2. Структура гемоглобина………………………….. | |
| 1.1.3. Солевые связи в структуре дезоксигемоглобина.. | |
| 1.1.4. Участок связывания кислорода в гемоглобине…. | |
| 1.1.5. Механизм кооперативного связывания кислорода………………………………………………………….. | |
| 1.1.6. Влияние дифосфоглицерата на сродство гемоглобина к кислороду…………………………………….. | |
| 1.1.7. Эффект Бора………………………………………. | |
| 1.1.8. Транспорт гемоглобином углекислого газа……... | |
| 1.1.9. Аномальные гемоглобины……………………….. | |
| 1.1.10. Другие переносчики кислорода: эритрокруорин, хлоркруорин, гемэритрин, гемцианин……………. | |
| Глава 1.2. Биосинтез гема………………………………… | |
| Глава 1.3. Транспорт и депонирование железа………... | |
| Глава 1.4. Катаболизм гемоглобина…………………….. | |
| Глава 1.5. Свертывающая система крови……………… | |
| 1.5.1. Фибрин…………………………………………….. | |
| 1.5.2. Коагулянтная фаза свертывания крови………….. | |
| 1.5.2.1. Синтез g-карбоксиглутаминовой кислоты и цикл витамина К…………………………………………. | |
| 1.5.3. Антикоагулянтная фаза…………………………... 1.5.4. Фибринолиз……………………………………….. | |
| Библиографический список……………………………… Часть 2. Биохимия движения…………………………….. | |
| Глава 2.1. Строение мышечного волокна....................... | |
| Глава 2.2. Биохимичнеский цикл мышечного сокращения………………………………………………………... | |
| Глава 2.3. Механизмы регуляции сокращения мышц | |
| 2.3.1. Актиновый механизм регуляции………………... | |
| 2.3.2. Миозиновая регуляция сокращения мышц…….. | |
| Глава 2.4. Модели сокращения мышечного волокна... | |
| Глава 2.5. Энергетика мышечного сокращения……… | |
| 2.5.1. Синтез креатинфосфата………………………….. | |
| 2.5.2. Гистидиновые дипептиды……………………….. | |
| Библиографический список……………………………… | |
| Часть 3. Биохимия межклеточного матрикса…………. | |
| Глава 3.1. Коллаген………………………………………. | |
| Глава 3.2. Эластин………………………………………… | |
| Глава 3.3. Гликозаминогликаны и протеогликаны….. | |
| 3.3.1. Строение и классы гликозаминогликанов………. | |
| 3.3.2. Метаболизм гликозаминогликанов……………… | |
| 3.3.3. Структура протеогликанов………………………. | |
| Библиографический список……………………………… |
Кудряшова Наталья Васильевна,
Мызина Светлана Дмитриевна
ФИЗИОЛОГИЧЕСКАЯ ХИМИЯ
|
|
|


