 |
Задачи для самостоятельного решения.
|
|
|
|
1. Удельная электропроводность 0,135 моль/л раствора пропионовой кислоты равна 4,8×10–2 См/м. Рассчитать молярную электропроводность пропионовой кислоты, константу диссоциации кислоты и рН раствора, если предельные подвижности ионов составляют при 298 К: l 0(Н+) = 349,8 См×см2/моль; l 0(С2Н5СОО–) = 37,2 См×см2/моль.
(Ответ: l = 3,55 См×см2/моль; K = 1,15×10–5 моль/л; рН = 2,91)
2. Удельная электропроводность 4% водного раствора H2SO4 при 18оС равна 0,168 См/см, плотность раствора 1,026 г/см3. Рассчитать молярную электропроводность раствора.
(Ответ: l = 2,00×10–2 См×м2/моль)
3. Константа диссоциации масляной кислоты С3Н7СООН равна 1,74×10–5 моль/л. Молярная электропроводность раствора при разведении 1024 л/моль равна 41,3 См×см2/моль. Рассчитать степень диссоциации кислоты и концентрацию ионов водорода в этом растворе, а также молярную электропроводность раствора при бесконечном разведении.
(Ответ: a = 0,125; [H+] = 1,22×10–4 моль/л; l 0 = 330,7 См×см2/моль)
4. Вычислить константу растворимости дигидрохлорида декамина R3N2+×2Cl– при 25°С, если предельная молярная электрическая проводимость его равна 2,209 См×м2/моль, удельная электрическая проводимость его насыщенного раствора равна 2×10–3 См/м, а воды для приготовления раствора – 1,2×10–6 См/м.
(Ответ: Ks = 2,96×10–18 (моль/л)3)
5. Найти степень и константу диссоциации масляной кислоты, если удельная электрическая проводимость ее раствора с концентрацией 0,0156 моль/л равна 1,81×10–4 Ом–1см–1.
(Ответ: a = 0,0303; Ka = 1,48×10–5 моль/л)
6. Удельная электрическая проводимость раствора, в 1,5 л которого содержится 4,43 г хлоруксусной кислоты, равна 2,41×10–3 См/см. Определить степень и константу диссоциации хлоруксусной кислоты в данном растворе.
|
|
|
(Ответ: a = 0,198; Ka = 1,53×10–3 моль/л)
7. По зависимости удельной электрической проводимости растворов гидроксида метиламмония CH3NH3ОН от его концентрации в растворе
| с, моль /л | 0,00782 | 0,01562 |
| k, См/м | 4,14×10–2 | 6,1×10–2 |
вычислить степень электролитической диссоциации гидроксида метиламмония и концентрацию ОН– в растворах. Проверить применимость закона разведения Оствальда. l 0 для гидроксида метиламмония равна 250 См×см2×моль–1.
(Ответ: a 1 = 0,2117; a 2 = 0,1563; с 1 = 1,656×10–3 моль/л; с 2 = 2,44×10–3 моль/л)
8. В сосуд (трубка с внутренним диаметром 2,26 см) для измерения электрической проводимости помещены круглые платиновые электроды диаметром 2,26 см. Расстояние между электродами 1,68 см. Сосуд заполнен 0,01 М NaNO3. При напряжении 0,5 В через данный раствор проходит ток силой 1,17 мA. Вычислить удельную и эквивалентную электрическую проводимость раствора NaNO3.
(Ответ: k = 9,81 См/м; l = 0,981×10–3 См×м2/моль)
9. При кондуктометрическом титровании 25 см3 HCl раствором гидроксида калия с концентрацией 5 М были получены следующие данные:
| V (5 М KОН), мл | 0,32 | 0,60 | 0,92 | 1,56 | 2,0 | 2,35 |
| k, См/м | 3,20 | 2,56 | 1,86 | 1,64 | 2,38 | 2,96 |
Рассчитать концентрацию соляной кислоты.
(Ответ: 0,248 М)
Электродные потенциалы и электродвижущие силы гальванических элементов
Электроды и электродные потенциалы
Основные уравнения
При соприкосновении разнородных фаз, содержащих заряженные частицы (ионы, электроны), например металлического электрода и раствора, содержащего соль этого же металла, происходит переход ионов через поверхность раздела из одной фазы в другую. При этом на границе раздела фаз возникает двойной электрический слой: два противоположно заряженных слоя частиц, которые остаются вблизи границы вследствие электростатического притяжения. В целом система остается электронейтральной.
Между находящимися в соприкосновении разнородными фазами, например ²металл² и ²раствор² возникает разность электрических потенциалов. Экспериментально измерить разность потенциалов между точками, расположенными в отличающихся по своему составу фазах (в металле и растворе), невозможно. На практике измеряют электродные потенциалы.
|
|
|
Электродным потенциалом называют ЭДС гальванического элемента (см. п. 1.6.2.2), составленного из данного электрода и стандартного водородного электрода (см. рис. 53).
Электродные потенциалы измеряются с помощью милливольтметров или иономеров, которые имеют большое входное сопротивление (более 1012 Ом). При этом измерительный ток так мал (менее 10–12 А), что гальванический элемент находится в состоянии очень близком к состоянию термодинамического равновесия.
Классификация электродов проводится по химической природе веществ, участвующих в электродном процессе.
Электродом первого рода называют систему, в которой восстановленной формой является металл электрода, а окисленной формой – простые или комплексные ионы этого же металла. Примером может служить система
Cu2+ + 2 e Cu,
для которой уравнение электродного потенциала (уравнение Нернста) имеет вид:

| (225) |
или при температуре 25°С (298,15 К)
 , ,
| (226) |
 . .
| (227) |
В этом уравнении символом  обозначен стандартный электродный потенциал – величина электродного потенциала при давлении каждого газа в системе равном 1 атм и активности каждого иона или молекулы, участвующей в электродной реакции, в растворе равной 1 моль/л. В справочных таблицах (Приложение 17) стандартные электродные потенциалы приводятся при температуре 25°С (298,15 К).
обозначен стандартный электродный потенциал – величина электродного потенциала при давлении каждого газа в системе равном 1 атм и активности каждого иона или молекулы, участвующей в электродной реакции, в растворе равной 1 моль/л. В справочных таблицах (Приложение 17) стандартные электродные потенциалы приводятся при температуре 25°С (298,15 К).
В символическом виде схема этого электрода записывается как Cu | Cu2+. Здесь вертикальная черта обозначает границу раздела между фазой металла и раствором. Как правило, электроды первого рода обратимы по катиону, то есть их потенциал является обратимой функцией активности катиона. Однако есть небольшое число электродов первого рода, обратимых по аниону, например:
2Te + 2 e  ,
,
для которого
 . .
| (228) |
Обратимость электрода относительно тех или других ионов означает зависимость его потенциала от активности (концентрации) данных ионов. Примерами металлических электродов типа М | М z + являются Zn | Zn2+, Cu | Cu2+, Ag | Ag+.
|
|
|
К электродам первого рода относятся также амальгамные электроды, в которых восстановленной формой служит амальгама какого-либо металла (например, цинка), а окисленной – ионы этого же металла:
Zn2+ + 2 e (Hg) Zn(Hg)
Поскольку в таких системах
Zn(Hg) | Zn2+
может изменяться концентрация как окисленной, так и восстановленной формы, то
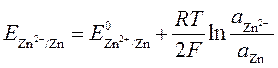 . .
| (229) |
где a Zn – активность цинка в амальгаме.
Электродом второго рода называют систему, в которой металл покрыт слоем его малорастворимой соли (или оксида), а раствор содержит анионы этой соли (для оксида – ионы гидроксила).
Примерами электродов второго рода являются хлорсеребряный (рис. 50) и каломельный электрод (рис. 51).
Хлорсеребряный электрод Ag, AgCl | Cl– представляет собой серебряную проволоку, покрытую слоем малорастворимой соли AgCl и опущенную в раствор, содержащий ионы хлора.
На практике чаще приходится использовать в ионометрии в качестве вспомогательного электрода стандартный хлорсеребряный электрод Ag, AgCl | KCl(нас.). Он представляет собой серебряную проволоку, покрытую слоем AgCl, опущенную в насыщенный раствор KCl, находящийся в стеклянном корпусе, в нижнем конце которого находится вплавленная асбестовая нить (рис. 50). Раствор, находящийся внутри хлорсеребряного электрода, очень медленно вытекает по капиллярам вдоль асбестовой нити и обеспечивает электролитический контакт с исследуемым раствором. Основному химическому процессу:
Ag+ + e Ag
в этом электроде сопутствует реакция растворения или осаждения малорастворимой соли:
AgCl Ag+ + Cl–.
Суммарный процесс
AgCl + e Ag + Cl–
определяет вид уравнения Нернста для потенциала этого электрода:
 . .
| (230) |

Рис. 50. Стандартный хлорсеребряный электрод:
1 – серебряная проволока; 2 – слой AgCl;
3 – насыщенный раствор KCl; 4 – жидкостное соединение
Хлорсеребряный электрод обратим относительно аниона хлора.
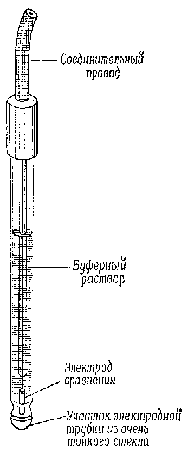
Каломельный электрод Pt| Hg, Hg2Cl2 | KCl представляет собой смесь металлической ртути Hg и каломели Hg2Cl2, помещенную в сосуд, в дно которого впаяна платина, приваренная к медному проводнику. С целью изоляции на медную проволоку надевают стеклянную трубочку, которую припаивают к сосуду и в которой проволоку закрепляют неподвижно. Платина в каломельном электроде служит переносчиком электронов. В сосуд наливают ртуть, так чтобы платина была ею покрыта. На ртуть помещают пасту, полученную растиранием ртути с каломелью в насыщенном растворе KCl, а затем насыщенный раствор KCl. Сосуд закрывают пробкой с отверстием для солевого мостика.
|
|
|

| 
|
| Рис. 51. Каломельный электрод | Рис. 52. Стеклянный электрод |
В соответствии с потенциалопределяющим процессом
Hg2Cl2 + 2 e 2Hg + 2Cl–
уравнение Нернста для потенциала каломельного электрода имеет вид:
 . .
| (231) |
Каломельный электрод, как и хлорсеребряный, также обратим относительно аниона хлора.
Благодаря простоте изготовления и высокой воспроизводимости потенциала хлорсеребряные и каломельные электроды широко применяют в качестве электродов сравнения при исследовании гальванических элементов. Хлорсеребряные электроды в паре со стеклянным электродом (рис. 52) применяют при измерении рН растворов и при определении концентраций других ионов с помощью ионоселективных электродов.
Во всех системах, отвечающих электродам 1 и 2 рода, одним из компонентов восстановленной формы является металл электрода. Если же инертный металл электрода не участвует в полуреакциях и является лишь передатчиком электронов между окисленной и восстановленной формой, то такие системы называются окислительно-восстановительными электродами. В качестве примера окислительно-восстановительных электродов можно привести систему
Pt | Fe3+, Fe2+
Fe3+ + e Fe2+
 . .
| (232) |
с платиновым электродом в качестве инертного переносчика электронов между окисленной и восстановленной формой.
Иногда в электродном процессе участвуют ионы водорода
Pt |  , H+, Mn2+
, H+, Mn2+
 + 8H+ + 5 e Mn2+ 4H2O
+ 8H+ + 5 e Mn2+ 4H2O
 . .
| (233) |
В таких системах окислительно-восстановительный электрод может служить индикатором рН раствора. Характерный пример – хингидронный электрод
Pt | C6H4O2, H+, C6H4(OH)2,
в котором протекает реакция
C6H4O2 + 2H+ + 2 e C6H4(OH)2
Хингидрон представляет собой комплексное соединение, образованное хиноном (Q) и гидрохиноном (QH2) При растворении хингидрона образуется их эквимолекулярная смесь, поэтому  и уравнение Нернста для хингидронного электрода принимает вид
и уравнение Нернста для хингидронного электрода принимает вид
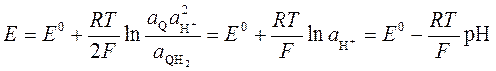 . .
| (234) |
Линейная зависимость между E и рН позволяет рассчитывать рН раствора по измеренному потенциалу хингидронного электрода. Недостатком этого электрода является невозможность его применения для измерения рН в щелочных растворах. В щелочной среде гидрохинон, являющийся слабой кислотой, депротонируется, при этом нарушается равенство активностей хинона и гидрохинона в растворе, линейность между E и рН нарушается, и измерение рН становится невозможным. В настоящее время для измерения рН вместо хингидронного электрода используется стеклянный электрод (рис. 52), который позволяет определять рН не только в кислых и нейтральных, но и в щелочных растворах.
|
|
|
Стандартные потенциалы простых окислительно-восстановительных электродов связаны со стандартными потенциалами электродов первого рода правилом Лютера. Поясним эту связь на примере медного электрода и ионов Cu2+ и Cu+. Восстановление ионов Cu2+ до металлической меди можно провести сразу
| Cu2+ + 2e Cu | 
|
или в две последовательные стадии:
| Cu2+ + e Cu+ | 
|
и
| Cu+ + e Cu+ | 
|
В равновесных условиях  , поэтому
, поэтому
 . .
| (235) |
Среди окислительно-восстановительных электродов выделяются газовые электроды. Газовый электрод состоит из инертного металла (часто платины или платинированной платины), к которому подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь при этом на атомы, а адсорбированные атомы участвуют уже непосредственно в электродной реакции.
Примером газового электрода является водородный электрод Pt, H2 | H+ (рис. 53). Он представляет собой платиновую пластинку, которая электролитически покрыта для увеличения поверхности платиновой чернью и погружена в раствор с определенной активностью ионов водорода. К платиновой пластинке и в раствор подается газообразный водород при заданном давлении. На поверхности платины устанавливается равновесие
2Н+ + 2 e Н2

|
Рис. 53. Водородный электрод. Для стандартного водородного электрода 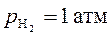 , , 
|
Потенциал водородного электрода зависит от температуры, концентрации ионов водорода в растворе и давления водорода на поверхности электрода:
 . .
| (236) |
Стандартный потенциал водородного электрода принят равным нулю, поэтому последнее уравнение упрощается:

| (237) |
Потенциалы отдельных электродов можно измерить только относительно какого-либо другого электрода. С этой точки зрения особое значение имеет стандартный водородный электрод, потенциал которого принят за 0 В. Условная запись такого электрода имеет вид
Pt, H2(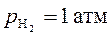 ) | H+(
) | H+( ).
).
Водородный электрод дает воспроизводимые значения потенциалов. Однако его недостатком является большая чувствительность к условиям работы: необходимы высокая степень чистоты водорода, поверхности платины, отсутствие окислителей и восстановителей в исследуемом растворе.
Примеры решения задач
1. Рассчитать электродный потенциал цинкового электрода, погруженного в 0,005 М раствор сульфата цинка, Т = 298 К. Пренебречь различием между активностью и концентрацией ионов цинка в растворе.
Решение:
Электродный потенциал цинкового электрода рассчитываем по уравнению Нернста, аналогичному (227):

При  получим
получим

2. Рассчитать потенциал серебряного электрода в насыщенном растворе AgI (K s = 8,3×10–17 М2), содержащем 0,01 моль/л NaI, при Т = 298 К.
Решение:
Запишем уравнение гетерогенного равновесия:
AgI(тв) Ag+(р-р) + I–(р-р)
и рассчитаем концентрацию ионов Ag+, пренебрегая концентрацией ионов иода, образовавшихся из малорастворимой соли, по сравнению с концентрацией ионов иода, введенных вместе с NaI

Электродный потенциал серебряного электрода рассчитываем по уравнению Нернста, аналогичному (227):


3. Рассчитать 298 K потенциал электрода, опущенного в раствор, в котором активности ионов  и Mn2+ одинаковы, а рН=1.
и Mn2+ одинаковы, а рН=1.
Решение:
В окислительно-восстановительной полуреакции


участвуют ионы водорода, поэтому потенциал этого электрода зависит и от активности ионов водорода (уравнение (233)):

Учтем, что а ( ) = а (Mn2+), а a (H+) = 10–рН = 10–1.
) = а (Mn2+), а a (H+) = 10–рН = 10–1.

4. Рассчитать при Т = 298,15 К электродный потенциал окислительно-восстановительного электрода Pt | Cu2+, Cu+, если активности CuCl2 и CuCl равны соответственно 0,01 М и 0,0005 М.
Решение:
Окислительно-восстановительный потенциал рассчитаем, используя уравнение Нернста, аналогичное уравнению (232)
 .
.
Так как стандартное значение электродного потенциала для электрода Pt | Cu2+, Cu+, на котором протекает реакция
Cu2+ + е– = Cu+, отсутствует, то рассчитаем его, пользуясь уравнением (235), полученным с помощью правила Лютера

Из этого уравнения следует, что


Подставляя стандартное значение электродного потенциала в уравнение Нернста, получим
 .
.
|
|
|


