 |
Методы определения поверхностного натяжения на легкоподвижных границах фаз
|
|
|
|
Поверхностное натяжение жидкостей легко определить экспериментально. Методы измерения поверхностного натяжения на жидких (подвижных) поверхностях раздела подразделяют на три основные группы:
1) статические (методы капиллярного поднятия и лежачей или висячей капли);
2) полустатические (методы максимального давления пузырька, отрыва кольца, отрыва пластинки, взвешивания или счета капель);
3) динамические (методы капиллярных волн, колеблющихся струй).
Наиболее точные результаты дают статические методы, которые основаны на изучении неподвижных менисков жидкости или профиля капель и пузырьков. В этих случаях поверхность жидкости находится в равновесии с ее объемом и не изменяется в ходе измерений. Динамические методы применяют, когда предполагается быстрое установление равновесия между поверхностным слоем и объемом жидкости. В противном случае (при медленном наступлении равновесия) полученные значения s не будут строго равновесными.
Для измерения поверхностного натяжения индивидуальных жидкостей пригодны все методы, поскольку между результатами, полученными статическими и динамическими способами, нет заметной разницы. У растворов же результаты измерений σ разными методами могут сильно отличаться из-за медленного установления равновесного распределения растворенных веществ между свежеобразованной поверхностью и объемом раствора. Это в особенности относится к растворам мицеллообразующих и высокомолекулярных ПАВ (белковые вещества, сапонины, высшие гомологи мыл). Получение в таких растворах равновесных значений поверхностного натяжения требует применения статических методов. Пригодны и некоторые из полустатических методов, например методы отрыва кольца, счета капель, наибольшего давления пузырьков и др. При простоте и удобстве работы эти методы дают вполне удовлетворительные результаты, если измерения проводят таким образом, что время формирования новой поверхности в виде капли является достаточным для установления концентрационного равновесия. В растворах низкомолекулярных ПАВ равновесные значения σ обычно достигаются менее чем за минуту; для растворов ПАВ более сложной структуры на установление равновесия может потребоваться до нескольких десятков минут в связи с медленной диффузией их молекул. Таким образом, для правильного выбора метода исследования необходимо учитывать кинетику установления равновесных значений поверхностного натяжения.
|
|
|
Одним из простых методов измерения поверхностного натяжения на границе «ж – г» является метод сталагмометра (метод счета капель). В нем поверхностное натяжение жидкости на границе с газом рассчитывают по уравнению:
 , ,
| (294) |
где s 0 – поверхностное натяжение чистого растворителя, n 0 и n – число капель чистого растворителя и раствора, вытекших из сталагмометра; r 0 и r – плотность растворителя и раствора.
Краевой угол смачивания
Малая капля жидкости, помещенная на твердую поверхность, может принять разную форму: либо близкую к сферической, как капля воды на поверхности парафина, либо форму тонкой линзы. В первом случае твердая поверхность плохо смачивается жидкостью (несмачивается), во втором – смачивается хорошо (смачивается).
По числу фаз, участвующих в процессе, различают два типа смачивания:
1) иммерсионное смачивание, имеющее место при полном погружении твердого тела в жидкость; в таком случае в смачивании участвуют две фазы: жидкость и твердое тело;
2) контактное смачивание, протекает с участием трех фаз: твердой, жидкой, газообразной (например, капля жидкости на твердой поверхности).
|
|
|
Количественной мерой процесса смачивания может служить угол, образованный каплей и твердой поверхностью. Этот угол называют краевым углом смачивания и обозначают θ. Значения θ могут меняться в пределах от 0 до 180°. Величину угла смачивания отсчитывают между твердой поверхностью и касательной, проведенной к поверхности капли в точке соприкосновения твердой, жидкой и газообразной фаз. Измерение угла производят со стороны жидкости (рис. 62).
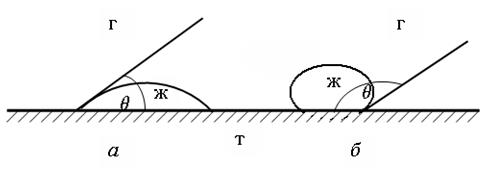
Рис. 62. Краевые углы смачивания:
а – смачивающая жидкость;
б – несмачивающая жидкость
Линию, по которой поверхность раздела жидкость — газ соприкасается с поверхностью твердого тела, называют периметром смачивания. Угол смачивания θ, который устанавливается при равновесии трехфазной системы (твердое тело – жидкость – газ), зависит только от поверхностных натяжений на границах раздела фаз. Если рассматривать поверхностное натяжение как силу, действующую тангенциально к поверхности раздела фаз, то связь между углом смачивания и поверхностными натяжениями можно выразить уравнением Юнга:
 , ,
| (295) |
 , ,
| (296) |
а σ тг, σ тж, σ жг и – три силы, действующие на единицу длины периметра смачивания (рис. 63). Произведение σ жгcos θ представляет собой проекцию вектора σ жг на горизонтальную плоскость (рис. 63, отрезок ОА).
 Рис. 63. Краевой угол при равновесном контактном смачивании
Рис. 63. Краевой угол при равновесном контактном смачивании
Из уравнения (295) следует, что процессом смачивания можно управлять, изменяя поверхностные натяжения в системе. Наиболее эффективным методом является введение ПАВ в жидкую фазу или предварительная обработка твердой поверхности растворами ПАВ. Таким путем можно не только влиять на величину смачивания, но и вызывать его инверсию, то есть качественно изменять характер смачивания.
Общая закономерность в процессах смачивания проявляется в том, что чем выше полярность жидкости, тем слабее ее смачивающие свойства: высокополярная ртуть смачивает только некоторые металлы, вода смачивает поверхности многих полярных веществ, органические жидкости (спирты, бензол, гексан) смачивают практически любую поверхность.
Величина поверхностного натяжения различных твердых тел, как и жидкостей, неодинакова, однако для твердых тел она значительно больше, чем для жидкостей.
|
|
|
Молекулярную природу твердых тел, их способность к взаимодействию с водой можно характеризовать гидрофильностью и гидрофобностью. Гидрофильные тела при одновременном контакте с водой и неполярной нерастворимой в воде жидкостью (углеводородом) избирательно смачиваются каплей воды. Последняя образует с их поверхностью краевые углы смачивания в пределах 0° < θ < 90°. Гидрофобные тела в тех же условиях избирательно смачиваются углеводородом, и капля воды с их поверхностью образует краевые углы смачивания 90° < θ < 180°.
Гидрофобное свойство проявляется в том, что взаимодействие между молекулами тела и воды слабее взаимодействия молекул воды между собой. Гидрофильное свойство характеризуется тем, что взаимодействие между молекулами воды слабее, чем взаимодействие между молекулами воды и твердого тела. В связи с этим гидрофобные поверхности твердых тел как бы противостоят смачиванию водой, а гидрофильные, наоборот, легко ею смачиваются.
На рисунке 64 показана форма капель жидкости на поверхности твердых тел с различной смачиваемостью; из этого рисунка видно, что по поверхности хорошо смачиваемых минералов капля жидкости (вода, масло) растекается, тогда, как для плохо смачиваемых минералов она остается на поверхности, сохраняя овальную форму.

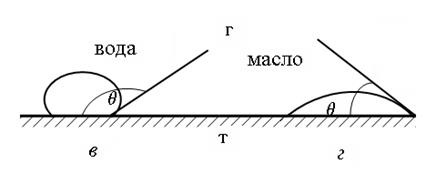
Рис. 64. Форма капель жидкости на поверхности твердых тел с различной смачиваемостью:
а, б – кварц (SiO2); в, г – свинцовый блеск (PbS)
Различные минералы характеризуются разной смачиваемостью. Так, сульфиды обычно гидрофобны, а оксиды – гидрофильны, причем степень их гидрофобности или гидрофильности различна. Чем больше смачиваемость минерала, то есть чем больше он обладает гидрофильными свойствами, тем меньше его флотационная активность и, наоборот, чем больше он гидрофобен, тем больше значение краевого угла смачивания и тем большей естественной флотационной активностью он обладает.
Весьма высокие значения краевых углов смачивания характерны для минералов: серы (до 80°), талька (до 70°), графита (до 60°), различных сульфидов (до 30–50°). Для окисленных руд черных металлов значения краевых углов довольно низки.
|
|
|
Природу твердой поверхности, а следовательно, и поверхностное натяжение можно изменить и превратить гидрофильную поверхность в гидрофобную (процесс гидрофобизации) и, наоборот, гидрофобную поверхность можно превратить в гидрофильную (процесс гидрофилизации) путем нанесения на поверхность твердого тела (минералов) тонкого слоя соответствующих веществ (рис. 65).
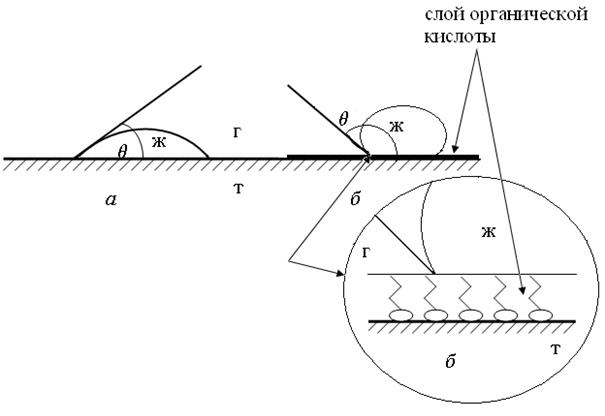
Рис. 65. Гидрофобизация поверхности:
а – обычная поверхность алюминиевой пластинки;
б – поверхность алюминиевой пластинки монослоем органической кислоты
Так, поверхность алюминиевой пластинки (рис. 65, а), в обычных условиях покрытая оксидной пленкой Аl2О3, гидрофильна, то есть хорошо смачивается водой (θ = 40°). Чтобы гидрофобизовать алюминиевую пластинку, достаточно покрыть ее раствором органической кислоты. Адсорбированные на поверхности пластинки молекулы кислоты образуют ориентированный слой, в котором полярные группы молекул обращены к поверхности пластинки, а углеродные цепи – в воздух. Как видно из рисунка 65, б, капля воды на обработанной органической кислотой алюминиевой пластинке образует краевые углы >90°.
Краевые углы смачивания легко измеряются экспериментально. Для этого применяются оптические методы, с помощью которых капля проектируется на экран или угол определяется непосредственно по оптическому изображению.
Явление смачивания тесно связано с действием сил когезии и адгезии.
Ø Когезией называют сцепление однородных молекул, атомов или ионов, которое включает все виды межмолекулярного и межатомного притяжения внутри одной фазы.
Когезия определяет существование веществ в конденсированном (твердом и жидком) состоянии. Такие состояния характеризуются высокой когезией. Газообразные вещества обладают малой когезией.
Ø Адгезия (прилипание) – это молекулярное притяжение между поверхностями двух соприкасающихся разнородных твердых или жидких фаз.
Адгезия является причиной склеивания двух разных фаз за счет действия физических или химических межмолекулярных сил.
Количественно когезию и адгезию характеризуют величиной работы когезииАс и работы адгезииАа.
Работа когезии (рис. 66, а) равна энергии, которую нужно затратить на разрыв сил сцепления между молекулами данной фазы. Численно работа когезии (Дж/м2) равна удвоенному значению поверхностного натяжения:
 . .
| (297) |
Работа адгезии (рис. 66, б) – это работа, затрачиваемая на отрыв молекул одной фазы от молекул другой фазы.
|
|
|
Рис. 66. Схема, иллюстрирующая понятия когезии (а) и адгезии (б) в плоскости А
По величине работы адгезии можно судить о прочности адгезионной связи (прочности прилипания, склеивания). Работу адгезии выражают в единицах поверхностного натяжения (Дж/м2). Адгезия сопровождается уменьшением поверхностной энергии. Это значит, что при совмещении разных фаз энергия Гиббса системы уменьшается на величину работы адгезии:
 . .
| (298) |
Адгезия жидкости, один из видов адгезионного взаимодействия, реализуется при контакте жидкости с твердой поверхностью. Если фаза 1 – газообразная, 2 – жидкая, а 3 – твердая (рис. 67), то применительно к адгезии жидкости к твердой фазе уравнение для работы адгезии можно представить следующим образом:
 . .
| (299) |
Полученное уравнение Дюпре (299) отражает закон сохранения энергии при адгезии.
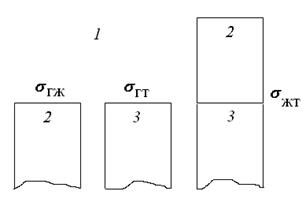
Рис. 67. К выводу соотношения между работой адгезии и поверхностными натяжениями взаимодействующих компонентов
Используя уравнение Юнга (295), работу адгезии жидкости можно записать следующим образом:
 . .
| (300) |
Явления когезии и адгезии играют важную роль во многих технологических процессах, в частности в технологии лекарств. Когезия и адгезия влияют на взаимодействие компонентов в сложных лекарственных формах, на распадаемость таблеток, прочность покрытия их оболочками, на процессы растворения и в конечном итоге на эффективность терапевтического действия. На явлениях адгезии основано действие клеев и связующих веществ.
Явление смачивания влияет на ход многих процессов в природе и технике, так как служит начальной стадией взаимодействия жидкостей с твердыми телами.
|
|
|


