 |
Определение порядка реакции по периоду полупревращения
|
|
|
|
В методе определения порядка реакции по периоду полупревращения используют различный характер зависимости t 1/2 от начальной концентрации реагента. Для реакций нулевого порядка t 1/2 прямо пропорционально начальной концентрации реагента (уравнение (260)), для реакций первого порядка не зависит от начальной концентрации реагирующего вещества (уравнение (265)), для реакций второго порядка – обратно пропорционально начальной концентрации (уравнение (269)).
| Реакция 0-го порядка | Реакция 1-го порядка | Реакция 2-го порядка | |||||

| 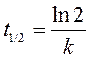
| 
| |||||
| с 0, М | t 1/2, с | с 0, М | t 1/2, с | с 0, М | t 1/2, с | ||
| 0,1 | 35,2 | 0,05 | 14,5 | 0,2 | |||
| 0,2 | 70,0 | 0,15 | 14,6 | 0,4 | |||
| 0,4 | 0,25 | 14,3 | 0,6 |
Для определения порядка изучаемой реакции необходимо экспериментально определить время полупревращения для нескольких начальных концентраций реагентов и установить, какая зависимость существует между ними. Для этого вначале анализируют экспериментальные данные в таблице, а затем, если зависимость между временем полупревращения и начальной концентрацией есть, строят в соответствующих координатах график, подтверждающий вид этой зависимости.
Значение константы скорости реакции находят по наклону прямой в соответствующих координатах используя или уравнение (260) (кинетика 0-го порядка), или (269) (кинетика 2-го порядка) или усреднением значений t 1/2 и расчетом константы по уравнению (265), если исследуемая реакция подчиняется кинетике 1-го порядка.
Дифференциальные методы
Метод Вант-Гоффа
Дифференциальный метод, предложенный Вант-Гоффом, заключается в следующем. Пусть изучается кинетика химической реакции
n AА + n BB ® … (270)
|
|
|
Если начальная концентрация реагента В значительно больше начальной концентрации реагента А, то концентрация В в процессе протекания реакции изменяется незначительно и может быть принята постоянной (метод избытка реагента). Тогда кинетическое уравнение:

| (271) |
упрощается
 , ,
| (272) |
где  .
.
Логарифмирование последнего уравнения приводит к линеаризованному уравнению:
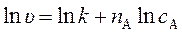 . .
| (273) |
Определяя в опытах скорость реакции при различных начальных концентрациях реагирующих веществ и строя график зависимости логарифма скорости реакции от логарифма концентрации, определяют коэффициент наклона полученной прямой, который будет равен порядку реакции по веществу, концентрация которого изменялась. Значение ln u при ln c A = 0 равно ln k. Отсюда находят константу скорости химической реакции k в уравнении (272).
Этот метод можно применять в двух вариантах. В первом варианте определяют скорость реакции как производную dc / dt при разных начальных концентрациях. Проводят касательные к кривым в момент начала реакции.
Во втором варианте проводят только один опыт. Обработка кинетической кривой заключается в расчете наклонов касательных к кривой в различные моменты времени, соответствующие различным значениям концентраций реагентов.
Результаты, полученные в том и другом варианте, используются для построения зависимости логарифма скорости от концентрации реагента.
Примеры решения задач
1. Определить методом подстановки порядок и константу скорости реакции A ® … по зависимости концентрации реагента от времени, прошедшего с момента начала реакции. Температура 298 К.
| № | t, c | c A, М | № | t, c | c A, М | |
| 0,180 | 0,0346 | |||||
| 0,128 | 0,0249 | |||||
| 0,0929 | 0,0177 | |||||
| 0,0681 | 0,0129 | |||||
| 0,0474 | 0,0092 |
Решение:
Рассчитаем константу скорости изучаемой реакции в предположении, что это реакция 0-го, 1-го и 2-го порядка по уравнениям (259), (264) и (268). Анализ рассчитанных значений констант показывает, что постоянные значения константы получаются при выборе уравнения (264) для реакции 1 порядка. Из графика видно, что ее значения случайно колеблются около некоторого среднего значения. Следовательно, исследуемая реакция имеет 1-й порядок по веществу А. Среднее значение константы скорости равно 0,00331 с–1.
|
|
|

| № | t, c | c A, М | Константа для реакции | ||
| 0 порядка | 1 порядка | 2 порядка | |||
| 0,180 | – | – | – | ||
| 0,128 | 0,000520 | 0,00341 | 0,0226 | ||
| 0,0929 | 0,000436 | 0,00331 | 0,0260 | ||
| 0,0681 | 0,000373 | 0,00324 | 0,0304 | ||
| 0,0474 | 0,000332 | 0,00334 | 0,0389 | ||
| 0,0346 | 0,000291 | 0,00330 | 0,0467 | ||
| 0,0249 | 0,000259 | 0,00330 | 0,0577 | ||
| 0,0177 | 0,000232 | 0,00331 | 0,0728 | ||
| 0,0129 | 0,000209 | 0,00330 | 0,0900 | ||
| 0,0092 | 0,000190 | 0,00330 | 0,1146 | ||
| Среднее значение константы, с–1 | 0,00331 |
2. Определить графическим методом порядок и константу скорости реакции A ® … по зависимости концентрации реагента от времени, прошедшего с момента начала реакции. Температура 298 К.
| № | t, c | c A, М | № | t, c | c A, М | |
| 0,180 | 0,0273 | |||||
| 0,0907 | 0,0241 | |||||
| 0,0590 | 0,0206 | |||||
| 0,0408 | 0,0193 | |||||
| 0,0328 | 0,0162 |
Решение:
Для определения порядка реакции этим методом рассчитаем по экспериментальным данным значения ln с, 1/ с и построим графики зависимостей " с – t ", "ln с – t ", "1/ с – t ", в которых линеаризуются кинетические уравнения (258), (262) и (267) реакций 0-го, 1-го и 2-го порядков соответственно.
| № | t, c | c A, М | ln [ с, М] | 1/ с, М–1 |
| 0,180 | –1,715 | 5,56 | ||
| 0,0907 | –2,400 | 11,0 | ||
| 0,0590 | –2,830 | 16,9 | ||
| 0,0408 | –3,199 | 24,5 | ||
| 0,0328 | –3,417 | 30,5 | ||
| 0,0273 | –3,601 | 36,6 | ||
| 0,0241 | –3,726 | 41,5 | ||
| 0,0206 | –3,882 | 48,5 | ||
| 0,0193 | –3,948 | 51,8 | ||
| 0,0162 | –4,123 | 61,7 |
| Зависимость для изучаемой реакции является прямолинейной, если использовать уравнение (267), выведенное для кинетики 2-го порядка. Следовательно, изучаемая реакция является реакцией второго порядка по реагенту А. | 
|
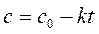
| |

| 
|
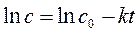
| 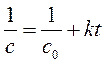
|
Константа скорости реакции в соответствии с уравнением (267) равна коэффициенту наклона 6,10×10–2 л/(моль×с) в уравнении прямой, которое найдено методом наименьших квадратов.
|
|
|
3. Определить порядок и константу скорости реакции A ® … по времени полупревращения, используя экспериментальные данные, полученные при 298 К
| с 0А, М | t 1/2, с |
| 0,0317 | 26,9 |
| 0,0528 | 44,8 |
| 0,0916 | 81,5 |
| 0,134 | |
| 0,294 | |
| 0,403 |
Решение:
Анализ экспериментальной зависимости времени полупревращения от начальной концентрации реагента А (таблица) позволяет из уравнений (260), (265) и (269)
 ,
, 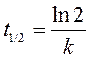 ,
,  ,
,
сразу отбросить второе (так как в соответствии с этим уравнением время полупревращения должно быть постоянным, а, судя по таблице, оно не постоянно) и третье уравнение (так как в соответствии с этим уравнением время полупревращения должно уменьшаться с увеличением начальной концентрации реагента, а оно увеличивается).
Остается первое уравнение, выведенное для кинетики 0-го порядка, однако необходимо проверить, действительно ли время полупревращения реагента А, найденное в эксперименте, прямо пропорционально начальной концентрации реагента. Для этого построим график зависимости в координатах " t 1/2 – c 0". Если в этих координатах зависимость будет иметь вид прямой, проходящей через начало координат, как и график уравнения (260), то это будет являться подтверждением того, что исследуемая реакция является реакцией 0-го порядка.

Прямолинейность графика и малая величина отрезка, отсекаемого на оси ординат при t 1/2 = 0 (2,3), подтверждают вывод о том, что исследуемая реакция имеет 0-ой порядок по реагенту А.
Константу скорости реакции находят из уравнения (260), которое, если выделить коэффициент перед начальной концентрацией, примет вид:
 .
.
Расчет коэффициентов прямой (t 1/2 = 848,1 с 0 + 2,3), выполненный по методу наименьших квадратов, приводит к ненулевому значению ординаты при с 0 = 0 (t 1/2 = 2,3). Этим отличием от нуля, которое возникает из-за ошибок, допущенных в эксперименте в определении времени и концентраций, в нашем случае можно пренебречь, так как ошибка в определении этого коэффициента прямой больше самого значения коэффициента (подробности расчета здесь не приводим).
|
|
|
Таким образом

и значение константы скорости равно
 .
.
4. Монохлоруксусная кислота при температуре 298 К гидролизуется (вода в большом избытке)
CH2ClCOOH + H2O ® CH2OHCOOH + HCl
Были проведены четыре эксперимента, в которых измерялась концентрация монохлоруксусной кислоты от времени (начальная концентрация кислоты была различна)
| t, мин | ||||
| c 1, М | 0,129 | 0,119 | 0,101 | 0,0925 |
| c 2, М | 0,0867 | 0,0787 | 0,0669 | 0,0616 |
| c 3, М | 0,0508 | 0,0466 | 0,0396 | 0,0363 |
| c 4, М | 0,0259 | 0,0237 | 0,0200 | 0,0186 |
Методом Вант-Гоффа определить порядок реакции и рассчитать кажущуюся константу скорости реакции.
Решение:
Так как вода взята в большом избытке, то можно применить метод Вант-Гоффа. Скорость реакцииравна (А – монохлоруксусная кислота)

По первым двум колонкам таблицы рассчитаем значения средних скоростей реакции (уравнение (252)) и соответствующие им средние значения концентраций (уравнение (253)), а также их натуральные логарифмы (в точных расчетах используют средние значения концентраций по времени; в ориентировочных эту величину можно заменить средней по концентрации).
| c сред | u сред | ln c сред | ln u сред |
| 0,124 | 0,0000500 | –2,087 | –9,903 |
| 0,0827 | 0,0000400 | –2,493 | –10,127 |
| 0,0487 | 0,0000210 | –3,022 | –10,771 |
| 0,0248 | 0,0000110 | –3,697 | –11,418 |
Для нахождения порядка и константы скорости реакции по коэффициентам уравнения (273) строим график в координатах "ln u – ln c A".
Угловой коэффициент уравнения рассчитанный по графику (рисунок) близок к 1; из этого следует, что порядок реакции по монохлоруксусной кислоте близок к 1, а кажущаяся константа скорости в уравнении (272) равна


|
|
|


