 |
Ответ: [NO]исх. = 1,2 моль/л, [O2] исх. = 0,8 моль/л
|
|
|
|
Задача
Равновесие гомогенной системы: 2 NO + O2 « 2 NO2, - установилось при следующих концентрациях веществ:
[NO]p. = 0, 8 моль/л., [O2]p. = 0, 6 моль/л, [NO2]p. = 0, 4 моль/л Вычислите исходные концентрации NO и O2.
 Дано: 2 NO + O2 « 2 NO2
Дано: 2 NO + O2 « 2 NO2
[NO]p. = 0, 8 моль/л, Решение:
[O2]p. = 0, 6 моль/л, 1. Cисх. = С равн. + С израсх к моменту равновесия
[NO2]p. = 0, 4 моль/л 2. Определим сколько моль NO и О2 израсходовано
[NO]исх. =? к моменту равновесия.
[O2]исх =?
Согласно уравнению реакции:
2 моль NO вступает в химическую реакцию и образуется 2 моль NO2
X моль NO - 0, 4 моль NO2
[NO] израсх. = 2 *0, 4/2 = 0, 4 моль
1 моль O2 вступает в химическую реакцию и образуется 2 моль NO2
Х моль О2 – 0, 4 моль NO2
[O2] израсх. = 0, 4/2 =0, 2 моль
3. [NO] исх. = 0, 8 +0, 4 =1, 2 моль/л
[O2] исх. = 0, 6 + 0, 2 = 0, 8 моль/л
Ответ: [NO]исх. = 1, 2 моль/л, [O2] исх. = 0, 8 моль/л
ТЕМА 6. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
РАСТВОРОВ
Раствор – это гомогенная термодинамически устойчивая во времени система, состоящая минимум из двух компонентов и продуктов их взаимодействия.
Любой раствор состоит из двух веществ – растворителя и растворённого вещества, причём растворителя в растворе всегда содержится в большем количестве, чем растворённого вещества.
1. Массовая доля растворённого вещества
Массовая доля растворённого вещества (ω р. в. , %) показывает сколько граммов растворённого вещества содержится в 100 граммах раствора.




ω % (р. в. ) = m(р. в. ) *100 % ,
m (р – ра) (1)
|
|
|
где m (р – ра) = m (р. в. ) + m (р – ля)
 |
Между массой раствора, объёмом и плотностью существует соотношение, т. к.
 (г/см3) или (г/мл), то т(р – ра) = ρ *V,
(г/см3) или (г/мл), то т(р – ра) = ρ *V,
|
А. Приготовление растворов с заданной массовой долей растворённого вещества ω 3 смешением двух растворов: с большей ω 1 и меньшей ω 2 массовой долей того же самого вещества.
При этом требуется найти массу более концентрированного (m1) и менее концентрированного (m2) растворов. Используется «правило креста», суть которого отражает схема:

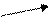 ω 1 m1 = ω 3 – ω 2
ω 1 m1 = ω 3 – ω 2
ω 3

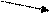 ω 2 m2 = ω 1 – ω 3
ω 2 m2 = ω 1 – ω 3
Пусть, например, требуется приготовить раствор с массовой долей 10% массой 70 г из 5 % и 40 %.
Подставим эти числа в приведённую ниже схему. Получаем:
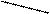
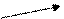 40 m1 = 10 – 5 = 5
40 m1 = 10 – 5 = 5

 10
10
5 m2 = 40 – 10 = 30
Откуда 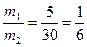
Например, взяв 10 г раствора ω = 40% и 60 г раствора с ω = 5%, получим 70 г раствора с ω = 10%.
Б. Приготовление растворов путём разбавления концентрированных растворов.
Так как при разбавлении растворов масса (р. в. ) неизменна (m*ω ) = const, то существует обратно пропорциональная зависимость между отношением масс растворов и их массовыми долями
|
2. Молярная концентрация раствора
Молярная концентрация раствора (См, моль/л. ) показывает число моль растворённого вещества, содержащегося в 1 л раствора.
СМ = n моль, если V в мл, то СМ = n*1000 ,
V л. V мл
где n = m (р. в. ),
М (р. в. )
|
(2)
Молярным называют раствор, в 1 л которого содержится 1 моль растворённого вещества.
|
|
|
Эквивалентом (Э) называется такое количество элемента или вещества (по массе), которое без остатка взаимодействует с 1 моль атомов или ионов водорода, с 1 моль электронов в окислительно-восстановительной реакции или 1 моль любого вещества в любой химической реакции.
Эквивалент – величина переменная для одного и того же вещества и рассчитывается по уравнению реакции или по формуле:
|
f (кислоты) = 1 ,
число ионов (Н+), участвующих в х. р.
f (основания) = 1 ,
число ионов (ОН‾ ), участвующих в х. р.
f (кислоты) = 1 ,
число ионов (Меn+) * n
где n- заряд иона металла.
3. Закон эквивалентов
|
Вид: , где Сн1 и Сн2 – молярная концентрация эквивалентов анализируемого и стандартного (концентрация которого точно известна) растворов, а V1 и V2 – соответственно их объёмы.
|
|
|


