 |
Равновесие двухфазной системы
|
|
|
|
Рассмотрим переход системы между фазами 1 и 2, например, переход вода–пар в закрытом изолированном сосуде.
Найдем химические потенциалы фаз в состоянии равновесия.
Для фазы  из (2.57)
из (2.57)
 . (2.57а)
. (2.57а)
Для изолированной системы суммарные значения
 ,
,
тогда вариации величин
 ,
,  ,
,  .
.
Для отдельных фаз получаем
 ,
,  ,
,  .
.
Величины 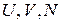 являются аргументами энтропии
являются аргументами энтропии  . При переходе системы между фазами эти аргументы не меняются, следовательно, в состоянии равновесия энтропия минимальна и ее вариация
. При переходе системы между фазами эти аргументы не меняются, следовательно, в состоянии равновесия энтропия минимальна и ее вариация
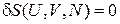 .
.
Из (2.57а) выражаем вариации энтропии фаз
 .
.
Энтропия является аддитивной величиной, тогда для системы
 .
.
 – независимые, тогда условия равновесия
– независимые, тогда условия равновесия
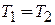 ,
,  ,
,  .
.
При наличии внешнего поля
 (2.60)
(2.60)
– для равновесной системы электрохимический потенциал одинаков в разных фазах и в разных местах одной фазы.
Если
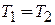 ,
,  ,
,  ,
,
то равновесия нет, идет диффузия.
Согласно второму началу термодинамики энтропия увеличивается
 .
.
Следовательно, d N 1 < 0 – частицы переходят из фазы 1 в фазу 2.
Частицы перемещаются в ту сторону, где химический потенциал меньше, повышая его величину и выравнивая химические потенциалы.
Получение химического потенциала
Для свободной энергии  используем
используем
 , (2.31)
, (2.31)
 , (2.57)
, (2.57)
получаем
 . (2.61)
. (2.61)
Из (2.61) находим
 . (2.61а)
. (2.61а)
Подставляем
 , (2.19)
, (2.19)
получаем
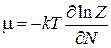 .
.
Для идеального газа из  одинаковых частиц
одинаковых частиц
 ,
,
где использована формула Стирлинга
 .
.
Тогда
 ,
,  ,
,
 .
.
В результате
 . (2.62)
. (2.62)
Для газа с поступательным движением частиц используем
 , (2.22)
, (2.22)
 , (2.62)
, (2.62)
получаем
 , (2.62а)
, (2.62а)
где  – концентрация. Химический потенциал увеличивается с ростом концентрации газа, с уменьшением температуры и массы частицы.
– концентрация. Химический потенциал увеличивается с ростом концентрации газа, с уменьшением температуры и массы частицы.
|
|
|
Вводим активность
 .
.
Активность показывает степень влияния процессов, происходящих в системе и описываемых химическим потенциалом, по сравнению с тепловой энергией. Используем
 , (2.62)
, (2.62)
находим
 . (2.62б)
. (2.62б)
Для гелия при
 ,
, 
из (2.62а) и (2.62б) получаем
 ,
,  .
.
Классический газ соответствует высоким температурам, низким концентрациям, большим расстояниям между частицы, когда действуют силы притяжения, поэтому химический потенциал отрицательный, активность мала
 ,
,  .
.
Термодинамический потенциал Гиббса 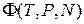
 . (2.64)
. (2.64)
Используем
 , (2.61)
, (2.61)
находим
 , (2.65)
, (2.65)
тогда
 .
.
При изменении N и фиксированных P и T из (2.65)
 .
.
Интегрируем по N
 (2.66)
(2.66)
– термодинамический потенциал Гиббса равен химическому потенциалу, умноженному на среднее число частиц системы.
Здесь и далее число частиц является характеристикой макросостояния, поэтому  .
.
Из
 (2.64)
(2.64)
и (2.66) получаем
 . (2.67)
. (2.67)
W-потенциал 
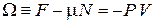 (2.68)
(2.68)
с учетом (2.67) Ω не зависит явно от числа частиц системы
 .
.
Из (2.68) и
 (2.61)
(2.61)
получаем
 ,
,
тогда
 ,
,
 ,
,
 . (2.69)
. (2.69)
Распределение ЧАСТИЦ по состояниям
Для газа с фиксированной температурой и концентрацией найдем среднее число частиц  в одном состоянии, т. е. на уровне с энергией ε. Частицы на энергетическом уровне отличаются проекциями импульса и положениями в пространстве.
в одном состоянии, т. е. на уровне с энергией ε. Частицы на энергетическом уровне отличаются проекциями импульса и положениями в пространстве.
Для трехмерного газа используем распределение Максвелла по энергии
 (2.48а)
(2.48а)
– среднее число частиц в единице объема с энергией в интервале  .
.
Концентрацию n выражаем через химический потенциал, используя
 , (2.62а)
, (2.62а)
тогда
 .
.
Множитель  выражается через энергетическую плотность состояний в единице объема
выражается через энергетическую плотность состояний в единице объема
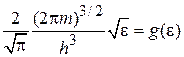 . (П.2.5)
. (П.2.5)
В результате (2.48а) получает вид
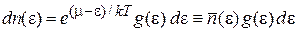 , (П.7.6)
, (П.7.6)
где среднее число частиц на уровне с энергией e
|
|
|
 (П.7.7)
(П.7.7)
– распределение по состояниям Максвелла – Больцмана;
 – активность.
– активность.
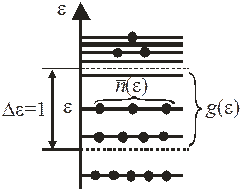
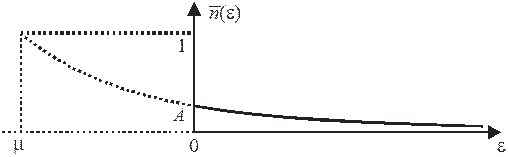
Среднее число частиц в единичном интервале энергии около e
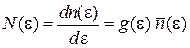 (П.7.8)
(П.7.8)
равно произведению числа состояний в единичном интервале энергии на число частиц в одном состоянии.
Для He при  ,
,  получено
получено
 ,
,  .
.
Из
 (П.2.5)
(П.2.5)

для He с  при
при  ,
,
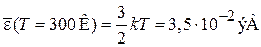
получаем
 ,
,
 ,
,
 .
.
Большое каноническое распределение
Описывает систему с  , обменивающуюся энергией и частицами с термостатом.
, обменивающуюся энергией и частицами с термостатом.
|
|
|


