 |
Объединённый газовый закон (уравнение Клапейрона)
|
|
|
|
Тема 1. Основные понятия и законы химии
Введение.
Химия является одной из фундаментальных естественных наук, так как она участвует в формировании мировоззрения человека, определяет его подход к окружающему миру.
В современной научно-технической революции химия играет исключительно важную роль. Нет ни одной отрасли промышленного производства, не связанной в той или иной степени с применением химии.
Химия как учебная дисциплина призвана дать студентам современное научное представление о веществе как одном из видов движущейся материи, о путях, механизмах и способах превращения одних веществ в другие. Химия знакомит будущего специалиста с конкретными проявлениями вещества, дает возможность с помощью лабораторного эксперимента «почувствовать» вещество, узнать его новые виды и свойства.
Перед современной химией стоят три главные задачи:
Во-первых, исследование строения вещества, развитие теории строения и свойств молекул и материалов.
Вторая задача осуществление направленного синтеза новых веществ с заданными свойствами. Здесь также важно найти новые реакции и катализаторы.
В-третьих, это анализ. Анализ в широком смысле этого слова. Анализ последствий воздействия человека на окружающую среду.
Химия – это наука о веществах их свойствах и превращениях, которые сопровождаются изменениями химических и физических свойств веществ.
Рекомендуемая литература при изучении курса химии.
1. Глинка Н. Л. Общая химия: Учеб. пособие для вузов – М.: Интеграл-Пресс,2002. – 728 с.
2. Угай Я. А. Общая и неорганическая химия: Учеб. для студентов вузов – М.: Высш. шк., 1997. – 527 с.: ил.
3. Коровин Н. В. Общая химия: Учеб. для технических напр. и спец. вузов. – М.: Высш. шк., 1998. – 559 с., ил.
|
|
|
4. Павлов Н. Н. Общая и неорганическая химия: Учеб. для вузов. – М.: Дрофа, 2002. – 448 с.: ил.
5. Коржуков Н. Г. Общая и неорганическая химия: Учеб пособие. – М.: «МИСИС»: Инфра-М, 2004. – 512 с.
6. Семенов И.Н., Перфилова И. Л. Химия: Учебник для вузов. – СПб: Химиздат, 2000. – 656 с.: ил.
7. Ахметов Н. С. Общая и неорганическая химия. Учеб. для вузов. – М.: Высш. шк., 1998. – 743 с., ил.
8. Горбунов А.И., Гуров А.А., и др. Теоретические основы общей химии: Учебник для студентов технических университетов и вузов. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2001. – 720 с.
9. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Изд-во «Астрель», 2004.
10. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991.
11. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия, 1988.
12. Задачи и упражнения по общей химии / Под ред. Коровина Н.В. М.: Высш. шк., 2003.
Основные понятия химии.
Весь окружающий нас многообразный мир всё существующее – это материя, которая проявляется в двух формах: вещества и поля.
Вещество состоит из частиц, имеющих собственную массу (массу покоя). Например: ионы, атомы, молекулы.
Поле – это такая форма существования материи, которая прежде всего характеризуется энергией. Например, электромагнитное поле, гравитационное поле, ядерное поле и др.
Вещество при известных условиях может превращаться в поле и наоборот – поле в вещество. Например, при горении вещество переходит в поле в виде световых фотонов; при столкновении позитрона с электроном обе частицы исчезают, и образуется два фотона: е++ е-=2hν.
Объектом изучения в химии являются химические элементы и их соединения.
Химическим элементом называют вид атомов с одинаковым зарядом ядер, то есть числом протонов. В свою очередь атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства.
|
|
|
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Тип атомов определяется составом его ядра.
Ядро состоит из протонов и нейтронов, вместе называемых нуклонами. Число электронов в атоме равно заряду ядра или порядковому номеру в периодической системе.
При химическом взаимодействии атомов образуется молекула.
Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов.
Молекулы являются составными частицами вещества. Если молекулы вещества состоят из одинаковых атомов, то вещество называют простым или элементарным. Например, Н2, О2, О3, Не. Если молекулы вещества состоят из разных атомов, то вещество называют сложным или химическим соединением. Например, СО, СО2, Н2О, Н2О2.
Все вещества являются соединениями химических элементов.
Вещества различают друг от друга по трем признакам:
1) элементным составом, например Н2О и Н2S; или HCl и HI различаются на один элемент;
2) взаимным расположением атомов. На этом свойстве основана аллотропия для простых веществ (например, расположение атомов углерода в алмазе и графите) и изомерия для сложных (например, бутан и изобутан);
3) по числу атомов, например, О3 и О2 или Н2О2 и Н2О.
Химическим превращением – называют образование молекул новых веществ путем их расчленения и перегруппировки, входящих в их состав атомов.
Все атомы обладают определенной массой. Современные методы исследования позволяют определить чрезвычайно малые массы атомов с большой точностью. Например, масса атома водорода равна 1,674·10-27 кг; масса атома кислорода = 2,667·10-26 кг. По абсолютному значению массы атомов изменяются в пределах от 10-27 до 10-26 кг, поэтому при химических расчетах удобнее пользоваться относительными атомными массами.
Относительная атомная масса химического элемента Ar – это величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к 1/12 массы изотопа углерода 12 ( ).
).

Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева. Например, Ar (С) = 12 а.е.м., Ar (О) = 16 а.е.м., Ar (Н) = 1 а.е.м.
|
|
|
Относительная молекулярная масса вещества Мr находится как сумма Ar атомов, из которых состоит молекула. Например:
Мr (Н2О) = 2· Ar (Н) + 1· Ar (O) = 2·1+1·16 = 18 а.е.м.
Мr (Н2SO4) = 2· Ar (Н) + 1· Ar (S) + 4· Ar (O) = 98 а.е.м.
В 1971 году в Международную систему единиц измерения (СИ) была введена единица количества вещества – моль. Моль (n) – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов) сколько атомов содержится в 12 г изотопа углерода 12. Число атомов в 12 г изотопа  равно 6,02·1023 атомов. Это число называется постоянной Авогадро N A, которая равна
равно 6,02·1023 атомов. Это число называется постоянной Авогадро N A, которая равна
N A = (6,022045 ± 0,000031)·1023 моль-1.
Число моль и постоянная Авогадро связаны между собой соотношениями
 ;
; 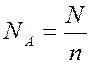 ;
;  ,
,
где N – число молекул (или других структурных единиц) вещества.
Масса 1 моль вещества называется молярной массой вещества, обозначается М (г/моль).
 ;
;  ;
;  .
.
Молярная масса вещества численно равна относительной молекулярной массе данного вещества. Например:
Мr (Н2О) = 18 а.е.м. М (Н2О) = 18 г/моль.
Молярный объём газа – показывает объём, который занимает любой газ количеством 1 моль, обозначается V М (м3/моль; л/моль; дм3/моль).



Число моль любого вещества можно найти следующим образом
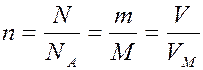
Основные законы химии
Закон сохранения массы (открыт М.В. Ломоносовым в 1748-1756 году).
Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии
При любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы из одного вида энергии в другой.
В производстве на основе этого закона ведутся расчеты тепловых балансов.
Закон сохранения химических элементов (открыт Лавуазье в 1789 г.).
При химических реакциях остается постоянной не только общая масса веществ, но и масса каждого из химических элементов. Закон выполняется для химических реакций (кроме ядерных, так как в ядерных реакциях одни элементы превращаются в другие).
|
|
|
Закон постоянства состава (открыт Ж. Пруст в 1801-1808 году).
Любое химически индивидуальное соединение имеет один и тот же количественный состав независимо от способа его получения.
Закон всегда выполняется для газообразных и жидких веществ. Для вещества находящегося в твердом состоянии, закон не справедлив.
Закон кратных отношений (открыт Дж. Дальтоном в 1808 году).
Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и туже массу другого, относятся между собой как небольшие целые числа.
Закон кратных отношений, как и закон постоянства состава, не является всеобщим, также не справедлив для веществ в твердом состоянии.
Газовые законы.
Закон объёмных отношений (открыт Ж. Гей-Люссаком в 1805 году)
При одинаковых условиях объёмы вступающих в реакцию газов, относятся друг к другу и к объёмам образующихся газообразных продуктов реакции как небольшие целые числа.
Например, при взаимодействии 2 объёмов водорода и 1 объёма кислорода образуются 2 объёма водяного пара. Эти числа совпадают со стехиометрическими коэффициентами в уравнении реакции:
2Н2 + О2 = 2Н2О.
Закон Авогадро
В равных объёмах разных газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул.
Из закона Авогадро вытекает ряд важных следствий:
1. При одинаковых внешних условиях одинаковое число молекул любого газа занимает одинаковый объём.
2. Равные мольные количества газов при одинаковых условиях занимают равные объёмы.
3. При нормальных условиях (н.у.), т.е. при температуре 0 °C (273К) и нормальном атмосферном давлении 101,312 кПа (760 мм рт ст или 1 атм) 1 моль любого газа занимает объём 22,4 л.
4. Молярная масса любого газа равна удвоенной относительной его плотности по водороду.
 ;
; 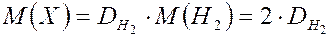 ,
,
где  - относительная плотность газа по водороду.
- относительная плотность газа по водороду.
Относительная плотность газов показывает во сколько раз 1 моль любого газа тяжелее или легче 1 моль другого газа. Относительная плотность газа может быть также по кислороду, по воздуху или по другому газу.
Закон парциальных давлений (открыт Дж. Дальтоном)
Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов составляющих смесь.

Парциальным давлением газа Рi в смеси называется давление, которое производил бы этот газ, если бы при тех же физических условиях он занимал объем всей газовой смеси. Его можно рассчитать по формулам:
Рi = 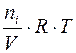 ,
,
Pi = xi × P,
где ni – число моль i -го газа в смеси;
 – мольная доля i- го газа в смеси.
– мольная доля i- го газа в смеси.
|
|
|
Объединённый газовый закон (уравнение Клапейрона)
Для приведения объёма газов к нормальным условиям используют уравнение Клапейрона

где Р0 – давление газа при н.у., V0 – объём газа при н.у., T0 – температура газа при н.у.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
|
|
|


