 |
Используют для вычисления молярных масс газов
|
|
|
|
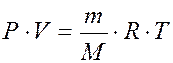

где Р – давление газа, V – объём газа, T – температура газа,
R –универсальная газовая постоянная (8,314 Дж/моль·К),
m – масса газа, M – молярная масса газа, n – количество моль газа.
Числовые значения R и её размерность в различных системах
| Числ. знач. R | 8,314 | 8,314 | 0,082 | 1,987 | |
| Ед. изм | 
| 
| 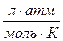
| 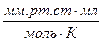
|  
|
Понятие эквивалента. Закон эквивалентов
Понятие эквивалент ввел в науку в начале XIX века Дж. Дальтон.
Эквивалентом Э (Х)называют некую реальную или условную частицу (атом, молекулу, ион, радикал и т.п.), которая может присоединять, замещать или быть каким-либо другим образом равноценна 1 моль атомов водорода или ионов Н+ в химических реакциях. В общем случае эквивалент элемента или вещества Х можно найти по формуле
Э(Х) =  ,
,
где z * - число эквивалентности, равное тому количеству атомов или ионов водорода, которое эквивалентно (равноценно) частице Х.
Масса 1 моль эквивалента вещества или элемента Х называется молярной массой эквивалента М Э(Х)(г/моль). Ее можно рассчитать по формуле:
М Э(Х) = М (Х) × Э(Х) =  .
.
Число эквивалентности z * для химического элемента, входящего в состав какого-либо вещества, равно модулю степени окисления (С.О.), проявляемой данным элементом в химическом соединении. Таким образом, расчет молярной массы эквивалента элемента следует вести по формуле
М Э(Элемент) = 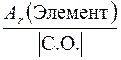 .
.
Для простого одноатомного вещества (например: Mg, P, S и т.д.) z * равно наиболее характерной валентности В элемента простого вещества. Тогда:
М Э(Х) =  .
.
Правила определения значения z * веществ и формулы для расчета их молярных эквивалентных масс во всех других случаях приведены в табл.1.
При решении задач с участием газообразных веществ обычно пользуются не М Э, а молярным эквивалентным объемом вещества V Э, то есть объемом, который занимает 1 моль эквивалентов газа. Расчет V Э газа (в дм3/моль) при н.у. следует вести по формуле
|
|
|
 ,
,
где Э – эквивалент элемента, составляющего газ; N – число атомов элемента в молекуле газа; 22,4 – молярный объем газа при н.у., дм3/моль.
Достаточно часто уравнения химических реакций записывают в сокращенно-ионной форме. Для ионов М Э вычисляют по формуле
М Э(иона) =  .
.
Таблица 1
Определение z * и расчет М Э простых и сложных веществ
| Тип реакции | Вещество | Определение числа эквивалентности z* | Формула для расчета М Э | Пример |
| Не участвует в реакции | оксид |  , где В – валентность элемента, N – число атомов элемента. , где В – валентность элемента, N – число атомов элемента.
| 
| Na2O: 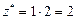 , ,
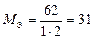 г/моль. г/моль.
|
| соль |  , где , где  – число катионов, – число катионов, 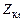 – заряд катиона. – заряд катиона.
| 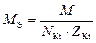
| AlCl3: 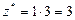 , ,
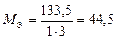 г/моль. г/моль.
| |
| основание | 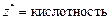 , то есть число ионов OH–, способных замещаться на анионы. , то есть число ионов OH–, способных замещаться на анионы.
| 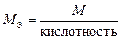
| Ca(OH)2:  , ,
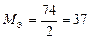 г/моль. г/моль.
| |
| кислота |  , то есть число ионов H+, способных замещаться на катионы. , то есть число ионов H+, способных замещаться на катионы.
| 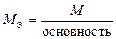
| H2SO4:  , ,
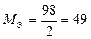 г/моль. г/моль.
| |
| ионного обмена | любое | 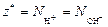 ,
где ,
где 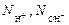 - число ионов Н+ или ОН–, переходящих от одного вещества к другому. - число ионов Н+ или ОН–, переходящих от одного вещества к другому.
|  или
или

| Al(OH)3 + 2HCl = = Al(OH)Cl2 + 2H2O
Для Al(OH)3:  , , 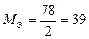 г/моль. г/моль.
|
| ОВР | любое | 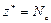 ,
где Ne – число электронов принятых (или отданных) окислителем (или восстановителем). ,
где Ne – число электронов принятых (или отданных) окислителем (или восстановителем).
| 
| 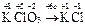 Для KClO3:
Для KClO3: 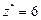 , , 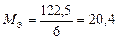 г/моль. г/моль.
|
§5. Закон эквивалентов.
Он был открыт Рихтером в 1793 году.
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Массы (объёмы) реагирующих веществ прямо пропорциональны их эквивалентным массам (объёмам).
Математически закон эквивалентов для условной реакции вида
А + В ® С + D
можно выразить различными способами. Например:
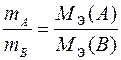 или
или 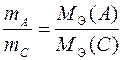 .
.
Если в реакции участвуют газообразные вещества, то закон эквивалентов целесообразнее записать как соотношение объемов
|
|
|
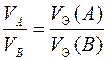 .
.
Наконец, когда один из участников реакции – газ, а другой – твердый реагент, то формула, выражающая закона эквивалентов, принимает вид
 .
.
|
|
|


