|
2.3. Состав пара над раствором. Законы Коновалова
|
|
|
|
2. 3. Состав пара над раствором. Законы Коновалова
Связь между изменениями состава равновесных фаз и изменениями давления и температуры была впервые рассмотрена в работах Д. П. Коновалова.
При T =const
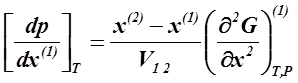
| (2. 5) |
При р =const

| (2. 6) |
Выражения ( 2. 5, 2. 6 ) − дифференциальное уравнение Ван-дер-Ваальса, где: V1. 2 − дифференциальный молярный объемный эффект превращения жидкости в пар.
При обычных T и р молярный объем пара намного больше молярного объема жидкости и поэтому V1. 2 > 0.
Согласно условию устойчивости, производная  также должна быть положительной для устойчивой фазы.
также должна быть положительной для устойчивой фазы.
Поэтому знак производной [dр/dx(1)]T в уравнении ( 2. 5 ) определяется знаком разности x(2)− x(1). Таким образом:
| если | 
| (2. 7) |
| если | 
| (2. 8) |
где: x(2) − молярная доля компонента в паре;
x(1) − молярная доля компонента в жидкости
Величина Q1. 2 (теплота образования пара из жидкости) при обычных T и P положительна. Тогда знак производной [dT/dx(1)]P в уравнении ( 2. 6 ) определяется только знаком разности x(2)− x(1):
| если | 
| (2. 9) |
| если | 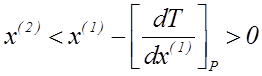
| (2. 10) |
Исходя из уравнений ( 2. 7− 2. 10 ) первый закон Коновалова можно сформулировать следующим образом:
1. Давление пара над раствором возрастает при увеличении в жидкости концентрации того компонента, содержание которого в паре больше, чем в растворе, т. е. легколетучего − B;
2. Давление пара над раствором уменьшается при увеличении в жидкости концентрации того компонента, содержание которого в паре меньше, чем в растворе, т. е. труднолетучего − A;
3. Температура кипения раствора уменьшается при увеличении в жидкости концентрации того компонента, содержание которого в паре больше, чем в растворе, т. е. легколетучего − B;
|
|
|
4. Температура кипения раствора возрастает при увеличении в жидкости концентрации того компонента, содержание которого в паре меньше, чем в растворе, т. е. труднолетучего − A.
Закон справедлив для тех случаев фазовых равновесий, когда одна из фаз газообразна (испарение, возгонка), т. к. только в этом случае можно утверждать, что дифференциальные объемные эффекты и дифференциальные теплоты образования одной фазы из другой положительны. Для испарения закон Коновалова может быть применен лишь при T и P, далеких от критических, т. к. вблизи критической точки, где свойства пара и жидкости одинаковы, знаки объемного эффекта и дифференциальной теплоты испарения лишены определенности.
Отклонения от закона Рауля нередко приводят к возникновению минимумов (максимумов) на кривых зависимости давления пара (температуры кипения) от состава фаз.
Свойства систем, обладающих экстремумами T или P, определяются с помощью второго закона Коновалова.
Преобразуя уравнения ( 2. 5, 2. 6 ) для условий экстремума, получим:
При T=const 
| (2. 11) |
При р=const 
| (2. 12) |
Так как V1. 2 и Q1. 2 − величины конечные, а (∂ 2G/∂ x2) > 0 для любой устойчивой фазы, экстремум р или T может наблюдаться лишь в том случае, когда x(1)=x(2).
Следовательно, второй закон Коновалова можно сформулировать так: в точках экстремума давления пара при изотермических условиях или температуры кипения при изобарических условиях составы пара и жидкости одинаковы.
В отличие от первого закона Коновалова, второй закон Коновалова справедлив при любых (в том числе и близких к критическим) температурах и давлениях, а также для любых случаев фазовых равновесий в двухфазных системах.
Из рассмотрения равенств ( 2. 11, 2. 12 ) видно, что экстремум давления пара на изотерме фазового равновесия обязательно сопровождается экстремумом температуры кипения на изобаре, т. к. оба экстремума обуславливаются равенством составов фаз. Однако производные T и р по составу вблизи экстремума имеют разные знаки. Максимум давления соответствует минимуму Tкипения и наоборот, минимум р отвечает максимуму температуры.
|
|
|
Растворы, обладающие экстремумами р и T, называются азеотропными (нераздельнокипящими).
Системы, имеющие азеотропы, широко распространены. При этом, наиболее часто встречаются растворы, обладающие максимумом р и минимумом Tкипения (вода − этанол, метанол − ацетон, бензол − уксусная кислота, бензол − циклогексан, метилциклогексан − толуол).
Азеотропов с минимумом р и максимумом Tкипения известно значительно меньше. К их числу относятся: вода − соляная кислота, вода − серная кислота, вода − муравьиная кислота, хлороформ − ацетон и т. д.
Третий закон Коновалова характеризует влияние изменения состава одной из фаз на состав другой фазы.
|
| (2. 13) | |

|
(2. 14) | |
Вышеприведенные производные характеризуют изменение состава одной фазы в зависимости от изменения состава другой при изотермических ( 2. 13 ) и изобарических ( 2. 14 ) условиях.
Если в системе вторая фаза — газ, то V2. 1 < 0 и Q2. 1 < 0, а V1. 2 > 0 и Q1. 2 > 0, т. е.
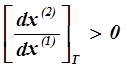 и и
| (2. 15) |

| (2. 16) |
Из неравенств ( 2. 15 ), ( 2. 16 ) следует: при изотермических и изобарических условиях составы раствора и пара изменяются симбатно.
Третий закон Коновалова имеет те же ограничения, что и первый закон Коновалова. В случае систем “раствор − пар”, он теряет свою силу для состояний, близких к критическому.
|
|
|