 |
3. Фазовые равновесия. В системе жидкость-жидкость с ограниченной растворимостью компонентов друг в друге. 3. 1. Системы с ограниченной растворимостью в жидком состоянии
|
|
|
|
3. Фазовые равновесия
в системе жидкость-жидкость С ОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ ДРУГ В ДРУГЕ
3. 1. Системы с ограниченной растворимостью в жидком состоянии
Системы, состоящие из двух жидкостей могут неограниченно растворяться одна в другой (например, вода – спирт), а могут ограниченно или частично растворяться друг в друге (например, вода – анилин и др. ).
В зависимости от природы смешиваемых жидкостей частичная растворимость одной в другой может быть большей или меньшей. Абсолютно нерастворимых жидкостей не существует, поэтому имеет смысл говорить об ограниченно растворимых жидкостях.
Растворение жидкостей друг в друге при данной температуре и давлении происходит до известного предела, связанного с насыщением жидкостей: дальнейшее прибавление избытка одной из них вызовет образование двух насыщенных слоев: например, в системе вода – анилин – водного, содержащего растворенный углеводород, и углеводородного с небольшим количеством растворенной воды.
Для таких конденсированных систем влияние давления на состав сосуществующих жидкостей невелико, т. е. внешнее давление можно принять постоянным и внешним параметром является только температура. Правило фаз Гиббса для данной системы: С= К – Ф+1.
В качестве независимых переменных при этом следует использовать либо температуру, либо концентрацию.
Повышение температуры вызывает сближение составов жидких фаз, однако, это бывает не всегда. Иногда при увеличении температуры взаимная растворимость жидкостей падает, что связано со знаком величины теплоты переходы из первой фазы во вторую, который в зависимости от природы системы может быть как положительными, так и отрицательными.
|
|
|
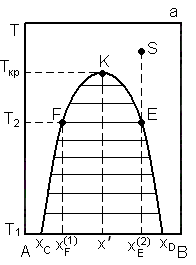
Зависимость температуры расслоения, т. е. образования двух фаз от состава раствора приведена на рис. 3. 1.
| p = const | ||
| 
| 
|
| Рис. 3. 1. Диаграммы взаимной растворимости жидкостей для систем различного типа | ||
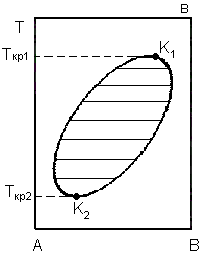
Кривые растворимости имеют различный характер. В одном случае (рис. 3. 1а) кривая растворимости имеет максимум, в другом (рис. 3. 1б) – минимум, в третьем случае (рис. 3. 1в) она представляет собой замкнутую кривую, т. е. имеет максимум и минимум.
На каждой из диаграмм любая точка, лежащая внутри области расслаивания, отвечает гетерогенной смеси., т е является двухфазной и моновариантной ( Ф=2, С=1 ). Область, находящаяся по другую сторону кривой растворимости, отвечает гомогенному раствору и бивариантна ( Ф=1, С=2 ). Левые ветви кривых характеризует растворимость компонентов В в А, правые – растворимость А в В.
В области расслаивания, ограниченной кривой растворения, показаны горизонтальные линии (конноды), которые связывают составы сосуществующих жидких слоёв. Количество фаз определяется по правилу рычага. По мере приближения к точкам максимума или минимума конноды становятся короче, а в точке К составы жидких слоев становятся одинаковыми.
Температура, при которой составы двух сопряженных растворов делаются одинаковыми называются критической температурой растворения Ткр. В случае, представленном на рис. 3. 1а – это верхняя критическая температура растворения, в случае, изображенном на рис. 3. 1б – это нижняя критическая температура растворения. Выше этой температуры (рис. 3. 1а) и ниже (рис. 3. 1б) оба компонента смешиваются неограниченно.
К системам с верхней критической температурой растворения относятся: фенол – вода, анилин – вода, дифениламин – вода и др. Системы триэтиламин – вода, диэтиламин – вода и β -коллоидин – вода имеют нижнюю критическую температуру растворения.
|
|
|
Известны также системы, обладающие как нижней, так и верхней критической температурой растворения: это глицирин – м -толуидин, никотин – вода, и др. Обе критические точки у таких систем лежат при различных составах.
Рассмотрим более подробно диаграмму с верхней критической точкой (рис. 3. 1а).
По мере прибавления (при Т1 ) компонента В к компоненту А сначала образуется гомогенный раствор В в А, а при составе, соответствующем точке хс, он становится насыщенным (фаза 1 ) и появляются первые капли также насыщенного раствора А в В состава хD (фаза 2 ).
Если исходить из чистого компонента В, прибавляя к нему компонент А, то при составе смеси хD появляется первая капля насыщенного раствора компонента В в А. При дальнейшем прибавлении одного из компонентов общий состав расслаивающейся жидкости будет изменяться, но составы слоев при данной температуре останутся неизменными.
Если увеличивать содержание компонента В в системе и дальше, то количество второй фазы будет увеличиваться, а количество первой фазы уменьшаться до тех пор, пока последняя совсем не исчезнет (на диаграмме этот момент соответствует точке хD ). Дальнейшее увеличение содержания компонента В приводит к тому, что вещества опять неограниченно растворяются друг в друге и система снова становится гомогенной.
При нагревании расслаивающейся жидкости состава 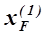 первоначально находящейся при температуре Т1, содержание первой фазы в ней постепенно уменьшается, а при температуре Т2 жидкость превращается в гомогенную. Наоборот, охлаждая гомогенный раствор s до температуры Т2, можно наблюдать первые признаки появления второго слоя состава
первоначально находящейся при температуре Т1, содержание первой фазы в ней постепенно уменьшается, а при температуре Т2 жидкость превращается в гомогенную. Наоборот, охлаждая гомогенный раствор s до температуры Т2, можно наблюдать первые признаки появления второго слоя состава 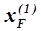 , а при дальнейшем понижении температуры относительное количество этого слоя будет возрастать.
, а при дальнейшем понижении температуры относительное количество этого слоя будет возрастать.
Используя правило Алексеева можно определить критическую точку растворения на кривой расслаивания.
Это правило гласит: середины коннод, соединяющих фигуративные точки сопряженных растворов, например F и Е, лежат на прямой линии, проходящей через верхнюю или нижнюю критическую точку растворения. Правило Алексеева, по-другому, можно назвать правилом прямолинейного диаметра Алексеева (прямая Fx´ ).
|
|
|


