 |
Электролитическое лужение. Свойства покрытий, области использования. Сравнит. хар-ка пористых и комплексных электролитов. Электродные процессы. Основные технологические параметры.
|
|
|
|
Основные положения
Эффекты, приводящие к снижению молярной электропроводности Электрофоретический эффект Эффект асимметрии, или релаксации при наложении электрического поля ион начинает двигаться в одну сторону, а его ионная атмосфера в противоположную; за счет взаимного притяжения центрального иона и противоположно заряженных ионов атмосферы возникает дополнительное трение, которое уменьшает подвижность ионов и молярную электропроводность при движении ион покидает свою ионную атмосферу и непрерывно на пути своего движения создает новую; разрушение и образование атмосферы происходит не мгновенно; в процессе разрушения старая шаровая симметрия ионной атмосферы искажается: ее плотность позади движущегося иона больше, что вызывает торможение движения иона
Число переноса, применяющаяся в электрохимических расчётах величина — отношение количества электричества, перенесённого ионами данного рода через какое-либо поперечное сечение раствора электролита, к общему количеству электричества, прошедшего через такое же сечение этого раствора. Число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (подвижностей) катиона и аниона. П. ч. является характеристикой, зависящей от подвижностей всех ионов в растворе электролита, от их концентрации и температуры раствора. Обычно Число переноса определяют по изменению концентраций ионов у электродов (метод И. Гитторфа). При электролизе ионы за счёт сольватации переносят не только электрический заряд, но также и растворитель в своих сольватных оболочках. Поэтому определённые методом Гитторфа Число переноса называют кажущимися, в отличие от истинных, учитывающих только скорости движения ионов.
|
|
|

С ростом температуры абсолютные скорости ионов и подвижности ионов увеличиваются, но не в одинаковой мере. Поэтому числа переноса с изменением температуры также меняются. При этом если число переноса катиона увеличивается, то число переноса аниона уменьшается, и наоборот.
Ввещества со смешанной проводимостью, в которых ток переносится электронами и ионами. К ним относятся, например, газы и пары в ионизированном состоянии.
18. Поляризационные явления в условиях одновременного протекания двух и более электродных реакций.
| n На основную катодную реакцию накладывается реакция выделения водорода | n На основную анодную — реакция выделения кислорода. |
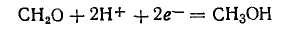
| 
|

| 
|
| n Катодное осаждение | n Анодное растворение |

| 
|
Процессы соосаждения металлов (электрохимическое получение сплавов)
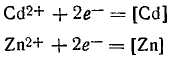
n Исходные положениея кинетики сложных электродных реакций:
n принцип независимости протекания совмещенных реакций — ПНПСР.
n Каждая из совмещенных электродных реакций протекает независимо от другой или других, т. е. так, как будто она является единственным процессом, идущим на данном электроде.
n Совмещенные реакции объединяются лишь общностью электродного потенциала, и скорость каждой из них определяется его значением.




| Компромисный потенциал |
Электролитическое лужение. Свойства покрытий, области использования. Сравнит. хар-ка пористых и комплексных электролитов. Электродные процессы. Основные технологические параметры.
ESn2+/Sn= -0,136 В. Стойкость Sn при воздействии орг.кислот и безвредность позволяет применять его покрытия в пищевой промышленности: изготовление белой жести, защита от коррозии хоз.предметов, покрытие деталей приборов и электрических контактов для последующей пайки. Sn-е покрытия наносят горячим или электролитическим способом. Преимущества электролитического способа – получение более равномерного осадка и более экономичное расходование олова. Защитные свойства Sn-х покрытий <, чем полученных горячим способом. Лужение осуществляется в кислых и щелочных электролитах, но из кислых – структура осадка более крупнокристаллическая и в них РС ниже. Поэтому для сложнопрофильных деталей применяютщелочные электролиты.
|
|
|
Кислые электролиты. Наиболее применимы сульф-е электролиты, в которых Sn находится в виде Sn2+: К: Sn2++2е→ Sn.
Из двух сортов катионов Sn2+ и Н+ разряжаются в основном Sn2+, т.к. ηН2 на Sn высокое. В отсутствие специальных орг. добавок наблюдается интенсивный рост изолир. кристаллов(дендриты). При введении в эл-т клея, крезола, фенола, тиомочевины − стр-а осадков становится более гладкой, плотной и блестящей. В сульф-м электролите возможно образование соединений Sn4+:
SnSO4+H2SO4+1/2O2↔Sn(SO4)2+H2O; Sn(SO4)2+4H2O↔Sn(OH)4+2H2SO4
Качество осадка зависит от условий электролиза (i и Т). При ↓i получаются крупнокристаллические осадки, ↑ Т сказывается плохо, т.к. ↑ скорость гидролиза.
Электролит: SnSO4 – 30-50 г/л; H2SO4 – 50-100 г/л;
Крезол или фенол 10−30 г/л; Столярный клей – 1-4 г/л.
Т=18-25оС, i=1-5 А/дм2;Вт=90-95%.Растворение Sn-х анодов протекает легко, Вта=100%.
Щелочные электролиты. ESn4+/Sn= +0,05 В. ESn2+/Sn= -0,136 В, т.е. в первую очередь восстановится 2-х валентное олово, а не 4-х валентное. В щелочных растворах важно поддержать А. в частично пассивном состоянии, тогда образуется исключительно олово 4-х валентное.Имеют преимущество при покрытии сложнопрофильных деталей. Основной компонент – Na2SnO3 и NaOH. В растворе могут присутствовать Na2SnO2:
Na2SnO3↔2Na++SnO32-; Na2SnO2↔2Na++SnO22-
SnO32-+Н2О→Sn4++ 6ОН-; SnO22-+Н2О→Sn2++4ОН-
На К возможен разряд ионов Sn2+ и Sn4+. Sn2+ разряжается без заметной поляризации, следов-но образуются крупные кристаллы. Ионы Sn4+ разряжаются со значительной хим.поляризацией, достигающей при i=1А/дм2 – обр-я плотные, мелкодисперсные осадки. С ↑ сод-я Sn в электролите кат-я поляризация ↓, с ↑ сод-я ОН- − наоборот. С ↑ i происходит ↓ВТк. Большая поляр-ть и изменение ВТ ↓ с ↑ i обеспечивает высокую РС станнатных электролитов.
На К также происходит 2Н++2е→Н2. ОН- играет роль лиганда − ↑ СОН- смещает равновесие в сторону ↓ СSn4+ и сдвигает Е в Э.О. сторону. Поэтому поддерживают умеренную конц-ю ОН-. Осаждение ведут при повышенных Т=65-70оС, т.к. при низких Т получают тёмные и рыхлые осадки. Анодное раств-е необходимо вести так, чтобы Sn растворялся в виде Sn4+. Если i низкая, образуется Sn2+. При повышенных i на А формируется окисная плёнка и Е сдвигается в Э.П. сторону, и тогда растворение А:
|
|
|
Sn→ Sn4++4е. При слишком высоких i растворение А прекращается и происходит:4ОН-→О2+2Н2О
Электролит, г/л: Na2SnO3∙3Н2О−50-100; NаОН−10-15; СН3СООNа−20-30.
Т=60-70оС, i=1,5-3 А/дм2;Вт=70-85%.
|
|
|


