 |
Сульфирование ароматических соединений
|
|
|
|
Ароматические углеводороды сульфируются значительно легче, чем алифатические, причем наиболее легко идет реакции с полициклическими углеводородами (антрацен, фенантрен и др.), труднее – с нафталином и бензолом. Сульфирование серной кислотой – это обратимый процесс:
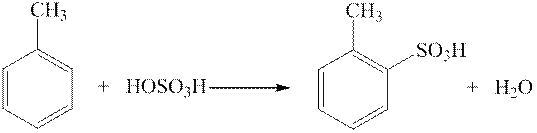
ArH + HOSO3H →← ArSO3H + H2O
Вода, выделяющаяся при реакции, понижает концентрацию серной кислоты, которая при этом теряет свои сульфирующие свойства, поэтому при сульфировании применяют избыток серной кислоты или используют олеум с таким содержанием SO3, которого достаточно для связывания выделяющейся воды.
Легкость сульфирования производных ароматических углеводородов зависит от природы заместителей, находящихся в кольце. Заместители I рода (OH, OR, NH2, Alk) облегчают введение сульфогруппы; заместители II рода (NO2, SO3H. COOH, Hal) затрудняют введение сульфогруппы. Важным фактором, влияющим на течение реакции сульфирования, является температура. Повышение реакции с одной стороны способствует ускорению реакции, с другой стороны, способствует образованию различных побочных продуктов (полисульфокислот, сульфонов, продуктов реакции окисления и конденсации). Кроме того, необходимо поддерживать необходимую температуру и для того чтобы контролировать место вхождения сульфогруппы по отношению к имеющемуся замести-телю. При сульфировании соединений с заместителями I рода повышение температуры способствует увеличению выхода пара -изомера. Например, при 00С из толуола образуют-ся орто- и пара -толуолсульфокислота примерно в равных количествах, а при 1000С полу –чается 79% пара -изомера и лишь13% орто- изомера. Сульфирование фенола при комнат-ной температуре приводит к образованию орто -фенолсульфокислоты, а при 1000С – к пара -изомеру.
|
|
|
Сульфокислоты являются трудно характеризуемыми веществами, так как большинство из них не имеют определенных температур плавления и кипения. Кроме того, при выделении свободных сульфокислот трудно освободиться от неорганических примесей
(из-за хорошей растворимости сульфокислот в воде). В связи с этим сульфокислоты вы-
деляют обычно в виде солей, которые могут быть очищены кристаллизацией, и многие из них имеют характерные температуры плавления.
Получение натриевой соли пара-толуолсульфокислоты
п- CH3C6H4SO3Na
Основные характеристики: М.в. 194,20 т.пл. - т.кип. -
Основная реакция:

Побочные реакции:


Реактивы и оборудование:
Толуол 16 мл (0,15 моль)
Серная кислота (плотность 1,835 г/мл) 9,5 мл (0,18 моль)
Углекислый натрий 8 г
Хлорид натрия 20 г
Колба круглодонная на 100 мл
Обратный холодильник
Стакан термостойкий
Воронка Бюхнера
Колба Бунзена
Магнитная мешалка с термонагревателем
Сборка приборов.
Прибор 1. В круглодонную колбу вставляют обратный холодильник и устанавливают на магнитную мешалку с нагревателем. В колбу помещают “якорек” для перемешивания.
Прибор 2. Колбу Бунзена с установленной в ней воронкой Бюхнера подсоединяют к водоструйному насосу.
Выполнение синтеза.
В круглодонную колбу прибора 1 помещают 16 мл толуола и осторожно приливают 9,5 мл серной кислоты. Реакционную смесь кипятят в течение 1 часа при перемешиваии.
Реакция считается законченной, когда слой толуола почти исчезает, а из холодильник лишь изредка стекают капли конденсата. Затем теплую реакционную массу выливают в стакан с 70 мл воды (если реакционная смесь начнет кристаллизоваться, ее необходимо подогреть) и колбу ополаскивают водой из промывалки. Кислый раствор осторожно нейтрализуют углекислым натрием, прибавляя его небольшими порциями, чтобы избежать вспенивания раствора. Затем добавляют в раствор 20 хлорида натрия и нагрева-
|
|
|
ют смесь до кипения. Полученный раствор охлаждают водой со льдом.
Выпавшие кристаллы натриевой соли п-толуолсульфокислоты отфильтровывают на воронке Бюхнера (прибор 2) и отжимают между листами фильтровальной бумаги. Выход продукта составляет ~8 г (~30%).
Контрольные вопросы
- Как называются вещества, которые получают при действии серной кислоты на органические соединения?
- Какие сульфирующие агенты используют для получения сульфокислот?
- Почему сульфирование толуола серной кислотой проводят при температуре 1000С?
- Как температура влияет на соотношение изомеров? Покажите примерами.
- Напишите побочные реакции, которые протекают при действии серной кислоты на толуол?
- Как заместители влияют на направление вступления сульфогруппы в бензольное кольцо?
- Почему сульфокислоты рекомендуется выделять в виде их солей?
- Где применяются сульфокислоты и их производные?
- Что произойдет, если при нейтрализации кислого раствора добавлять соду одним приемом? Напишите реакцию, которая при этом происходит.
|
|
|


