 |
Загадочное лучистое вещество. Подсчет атомов
|
|
|
|
Загадочное лучистое вещество
Новые мысли зародились в результате опытов с катодной трубкой и магнитом.
Когда к трубке поднесли магнит, катодный луч изогнулся наперерез силовым линиям магнитного поля (рис. 36).
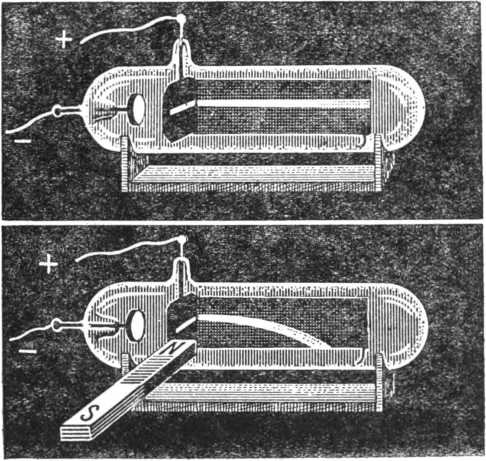
Рис. 36. Когда к трубке поднесли магнит, то катодный луч изогнулся наперерез магнитным силовым линиям.
Лучи, как видимые – световые, так и невидимые – инфракрасные и ультрафиолетовые, не отклоняются магнитом. Светоносная же струйка в катодной трубке повинуется влиянию магнита, значит, она не световой луч, а именно струйка! Но чего? Частиц какого‑ то вещества?
Это вещество не может быть металлом катода. Когда катод распыляется, его частицы летят не так, как движется неизвестная материя катодного луча. И это не частицы воздуха, так как катодный луч проходит в трубке, даже при самой высокой степени разрежения воздуха.
Исследователи попробовали повернуть магнит, расположенный возле катодной трубки. Его укрепили так, чтобы северный полюс оказался на месте южного, а южный – на месте северного. От перестановки магнита катодный луч изогнулся в противоположную сторону. Если в начале опыта он отклонялся вниз, то теперь он выгнулся вверх. Словом, поведение катодного луча напоминало движение провода с током в магнитном поле (см. выше рис. 25).
Эти странные явления допускали только одно, естественное объяснение: катодный луч не что иное, как поток отрицательных зарядов – мельчайших частичек отрицательного электричества, то есть электрический ток.
Уже явление электролиза наводило на мысль о существовании элементарных зарядов. Но там эти заряды были связаны с обломками молекул – с ионами, которые служили им «лодочками». Здесь же они выступали самостоятельно, так сказать, в чистом виде и летели в безвоздушном пространстве катодной трубки «вольными птицами».
|
|
|
Но можно ли сказать, что заряды, путешествующие на ионах, и заряды, образующие катодный луч, – это одни и те же заряды? Равны ли они между собой по величине? Нет ли между ними какой‑ либо разницы?
На эти вопросы ученые смогли дать ответ только после ряда новых опытов.
Подсчет атомов
К 90‑ м годам прошлого столетия атомистическая теория торжествовала полную победу. Атомы существуют! Это считалось окончательно доказанным. Правда, физики того времени представляли атом несокрушимо прочным шариком или кирпичиком, который никоим образом нельзя разбить на части, но это временное заблуждение тогда еще не мешало развитию науки.
В ту пору было известно 75 различных видов или сортов атомов, иначе говоря – 75 химических элементов. [5] Каждый химический элемент состоит из своих атомов: золото – из атомов золота, ртуть – из атомов ртути и так далее.
Были раскрыты законы, по которым атомы, соединяясь между собой, образуют молекулы простых веществ и химических соединений.
Ученые определили вес атомов каждого химического элемента, приняв за единицу измерения одну шестнадцатую долю веса атома кислорода.
Великий русский ученый Дмитрий Иванович Менделеев в 1869 году построил свою знаменитую периодическую систему элементов, о которой речь будет впереди. Он уточнил определение атомных весов химических элементов и привел в стройный порядок все накопленные наукой знания об атомах.
Физики, совместно с химиками, сумели сосчитать число атомов, содержащихся в одном грамме любого химического элемента. Выяснилось, что 6, 023∙ 1023 атомов водорода весят 1 грамм, а 6, 023∙ 1023 атомов любого другого элемента весят столько граммов, сколько единиц в атомном весе этого химического элемента. Значит порция азота весом в 14 граммов содержит столько же атомов, сколько и порция кислорода в 16 граммов, или порция натрия в 23 грамма и так далее.
|
|
|
Поэтому вычисление количества атомов в одном грамме любого простого тела оказалось очень несложным делом. Надо число[6] 6, 023∙ 1023 разделить на атомный вес химического элемента. Частное от деления покажет, сколько атомов составляют один грамм. Например, атомный вес ртути равен 200, 61. Делим 6, 023∙ 1023 на 200, 61 и получаем 3∙ 1021. Это и есть число атомов в одном грамме ртути.
Столь несложным способом можно вычислить сколько атомов содержится б любом куске золота, железа, углерода или какого‑ либо иного простого тела.
Найденное правило действительно не только по отношению к атомам. С его помощью можно определить число молекул, составляющих один грамм любого химического соединения. Для этого вместо атомного веса надо знать молекулярный вес химического соединения. Например, молекулярный вес воды (Н2O) равен 18, следовательно один грамм воды состоит из 3, 34∙ 1022 молекул, так как 6, 023∙ 1023: 18 = 3, 34∙ 1022.
Успехи атомистической теории чрезвычайно помогли разобраться в сущности электрических явлений.
|
|
|


