 |
17. Механизм действия буферных систем. Буферные системы крови
|
|
|
|
17. Механизм действия буферных систем. Буферные системы крови
Механизм буферного действия рассмотрим на примере ацетатной БС: СН3СООН/СН3СОО- +Na+,
где СН3СООН – слабая кислота, а СН3СОО-+Na+ - соль, образованная сильным основанием (NaOH).
При добавлении:
а) сильной кислоты (избытка протонов) ацетат-анион связывает этот избыток протонов (т. е. проявляет свойства основания) с образованием эквивалентного количества слабой уксусной кислоты:
СН3СОО- + Н+ ↔ СН3СООН
Несмотря на увеличение общей кислотности, активная кислотность вырастет мало, так как оно произошло за счёт увеличения концентрации слабой кислоты, степень диссоциации которой понизится согласно закону Оствальда.
б) сильного основания (щёлочи, избытка ОН--анионов) она нейтрализуется за счёт резервной кислотности:
СН3СООН + ОН- ↔ СН3СОО- + Н2О.
Активная кислотность при этом изменяется незначительно, так как согласно закону Оствальда уменьшение концентрации слабой кислоты приводит к росту степени её диссоциации.
Обратите внимание, что катион металла, входящего в состав соли, не принимает участие в буферном действии.
При разбавлении и концентрировании рН не изменяется, так как остаётся прежним соотношение компонентов БС
Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая
Бикарбонатная (гидрокарбонатная) БС (Н2СО3/НСО3-) – мощная система плазмы крови, составляющая примерно 10% от её общей буферной ёмкости. В норме соотношение компонентов (гидрокарбонат-анион / угольная кислота) равно 20.
Механизм действия бикарбонатной БС в организме аналогичен таковому ацетатной БС, с той лишь разницей, что при увеличении концентрации угольной кислоты, она интенсивно разлагается под действием фермента карбангидразы: Н2СО3 ↔ Н2О + СО2↑.
|
|
|
Образующийся при этом углекислый газ удаляется с выдыхаемым воздухом.
Фосфатная БС. Образована двумя ионами: гидро- и дигидрофосфат-анионами: НРО42-/Н2РО4-
Первый из них выполняет роль соли, второй – слабой кислоты. На долю фосфатной БС приходится примерно 1% буферной ёмкости крови. Механизм её действия аналогичен описанному выше.
Белковая БС имеет меньшее значение в поддержании рН. Благодаря амфотерным свойствам белков, состав белковой БС условно можно представить, как белок-кислоту (НООС–Pr–NH3+) и белок-основание (-ООС–Pr–NH2), где Pr – протеин (белок). При добавлении в систему протонов они последовательно будут связываться с оснό вными группами:
-ООС–Pr–NH2+ Н+ → -ООС–Pr–NH3+,
-ООС–Pr–NH3+ + Н+ → НООС–Pr–NH3+.
При добавлении в систему гидроксид-ионов они последовательно будут нейтрализоваться протонами, отщепляющимися от кислотных групп:
НООС–Pr–NH3+ + ОН- → -ООС–Pr–NH3+ + Н2О,
-ООС–Pr–NH3+ + ОН- → -ООС–Pr–NH2 + Н2О.
Гемоглобиновая БС – самая мощная в организме. Она действует в эритроцитах, обеспечивая примерно 76% буферной ёмкости крови. Она состоит из 2 сопряжённых кислотно-основных пар:
HHb и H++HbO2-
K++Hb- и K++HbO2-,
где HHb – дезоксигемоглобин, K++Hb- - его калиевая соль; H++ HbO2- - оксигемоглобин, являющийся более сильной кислотой, чем дезоксигемоглобин, а K++HbO2- - калиевая соль оксигемоглобина. Действует гемоглобиновая БС согласованно в периферических тканях и лёгких. В лёгочных капиллярах при высоком парциальном давлении кислорода гемоглобин на 98% насыщается кислородом, образуя оксигемоглобин. Оксигемоглобин как более сильная кислота, чем угольная, вытесняет её из гидрокабонат-аниона, поступающего из периферических тканей. Выделившаяся угольная кислота под действием фермента карбангидразы разлагается на воду и углекислый газ, удаляемый с выдыхаемым воздухом: HHb + О2 → H+ + HbO2-
|
|
|
H+ + HbO2- + К+ + НСО3- → K+ + HbO2- + Н2СО3; Н2СО3 → Н2О + СО2↑.
В капиллярах периферических тканей, при низком парциальном давлении кислорода последний освобождается и используется в процессах биологического окисления. Дезоксигемоглобин, будучи более слабой кислотой, чем угольная, образует молекулярную форму:
K++H++HbO2- → K+ + HHb + О2.
Источником протонов и гидрокарбонат-анионов является угольная кислота, образующаяся в периферических тканях из продуктов метаболизма – воды и углекислого газа. Следует обратить внимание, что гемоглобиновая БС является плазменно-клеточной и действует совместно с бикарбонатной.
18. Типы окислительно-восстановительных (редокс) реакций в организме
Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления двух или более веществ.
Степень окисления – это условный заряд на атоме, если считать, что молекула создана по ионному механизму (или – это количество принятых или отданных электронов).
Восстановители – атомы, молекулы, ионы – отдающие электроны.
Окислители - атомы, молекулы, ионы – принимающие электроны.
Восстановители участвуют в процессе окисления, повышая свою степень окисления. Окислители - участвуют в процессе восстановления, понижая свою степень окисления.
Виды окислительно-восстановительных реакций:
1. Межмолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
2. Внутримолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
3. Диспропорционирование (самоокисление-самовосстановление) - реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
4. Репропорционирование (конпропорционирование, контрдиспропорционирование) - реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
|
|
|
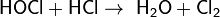
Типы окислительно-восстановительных реакций в организме человека:
1. Реакция дегидрирования: SH2 + HAD+ → S + HADH+H+
2. Потеря электрона: O20 + 1e → O2-
3. Перенос 2Н+ от восстановленного субстрата на молекулярный кислород: SH2 + O20 +2e → S + H2O
4. Присоединение кислорода к субстрату: SH2 + ½ O20 +2ē → HO-S-H
|
|
|


