 |
Способы выражения концентрации раствора.
|
|
|
|
Основные способы выражения состава растворов
Массовая доля _______________________
Молярная концентрация ____________________
Массовая концентрация _____________________
Моляльная концентрация ____________________
Формулы перехода от одних способов выражения состава раствора к другим
(см.Сборник задач и упражнений по общей химии. Приложения.Таблица 1)
Практикум стр.5 -32
Задания для самостоятельной работы
из «Сборника задач и упражнений по общей химии».
1.22; 1.26; 1.29;1.34;1.37;1.41:1.46
Дата _________
Лабораторная работа 2.4
Определение массы гидроксида натрия в растворе
Цель работы: Приобрести навыки выполнения титриметрического анализа.
Оборудование и реактивы: Бюретка вместимостью 25 мл, пипетка Мора вместимостью 5 мл, мерная колба вместимостью 100 мл, коническая колба вместимостью 250 мл, конические колбы вместимостью 50 – 100 мл, разбавленные растворы азотной кислоты и гидроксида натрия, раствор метилового оранжевого и фенолфталеина, вода дистиллированная.
Сущность работы:
Прямое ацидиметрическое определение массы щелочи в растворе по реакции:
NaOH + HNO3 ¾® NaNO3+ H2O
Концентрация щелочи в контрольном растворе рассчитывается по результатам кислотно-основного титрования:
с(1/zHNO3)×V(HNO3)
с(1/zNaOH) = ¾¾¾¾¾¾
Vаликвотной доли(NaOH)
Масса вещества в растворе рассчитывается по формуле:
m(NaOH) = c(NaOH)× V(NaOH)× M(NaOH)
Выполнение эксперимента:
1. Приготовить бюретку к работе.
2. Приготовить пробы анализируемого раствора для титрования.
|
|
|
3. Провести титрование проб до трех сходящихся результатов с точностью до 0,1 мл.
Экспериментальные данные:
| № п/п | Объём аликвотной доли анализируемого раствора, Vа мл | Индикатор | Объём титранта V мл | Средний объём титранта,V мл |
|
| ||||
Расчеты: NaOH + HNO3 → NaNO3 + H2O
n (1/z NaOH) = n (1/z HNO3)
z(NaOH) = z (HNO3) =
c (NaOH) Vаликвотной доли(NaOH) = c(HNO3) V(HNO3)
m (NaOH) = c(HNO3) V(HNO3) Vмерной колбы M(NaOH)/ V аликвотной доли
*В выводах указывают полученный результат, метод исследования, используемые индикаторы. Вычисляют относительное отклонение от массы гидроксида натрия, указанной преподавателем.
Вывод:
Задания для самостоятельной работы
из «Сборника задач и упражнений по общей химии».
1.61; 1.63; 1.64
Дата _______ Занятие ___________
МОДУЛЬ №02. Химическая термодинамика. Энергетика химических реакций.
I начало термодинамики. Энтальпия. Закон Гесса.
Задания для самостоятельной работы
2.19; 2.45; 2.57; 2.61
Лабораторная работа 3.1
Определение стандартной энтальпии реакции нейтрализации.
Цель работы: Научиться калориметрически определять энтальпии реакции нейтрализации.
Приборы, оборудование и реактивы: Макет калориметра, термометр с ценой деления 0,1о(10), мерные цилиндры, растворы кислоты и основания.
Сущность работы: Теплота реакции нейтрализации определяется калориметрически по измеренному изменению температуры и рассчитанной теплоемкости системы.
Лабораторный калориметр
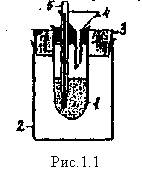
1 – стакан, находящийся в большом термоизоляционном стакане 2, снабженном крышкой 3. С внутренним пространством калориметрического стакана контактируют воронка; и химический термометр 5.
|
|
|
Энтальпия реакции нейтрализации, протекающей между сильными одноосновными кислотами и сильными однокислотными основаниями практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция:
Н+(aq) + ОН–(aq) = Н2О(ж); DН°r = -57,3 кДж/моль.
В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянства не наблюдается, так как часть теплоты расходуется на ионизацию слабой кислоты и слабого основания.
Выполнение эксперимента:
1. Измеряют температуру исходных растворов кислоты и щелочи.
2. Измеряют температуру раствора после проведения реакции.
Экспериментальные данные.
| № опыта | Температура раствора, о С | ||
| кислоты (исх) | щелочи (исх) | после нейтрализации | |
| 1 | |||
| 2 | |||
| 3 | |||
| Среднее значение | |||
Концентрации растворов кислоты ________ моль /л, щелочи_______ _ моль /л,
Объемы растворов реагирующих веществ мл_____
Плотности растворов_______________г/мл_
Масса калориметрического стакана г
Справочные величины
Суд (воды) = 4,184 Дж/г×К Суд (стекла) = 0,753 Дж/г × К
|
|
|



