 |
Молярная электрическая проводимость
|
|
|
|
Молярная электрическая проводимость – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объема (V, см3) раствора, в котором содержится
1 моль растворенного электролита, причем электроды находятся на расстоянии 1 см друг от друга.
Из определений удельной и молярной электрических проводимостей следует, что они связаны соотношением:
 , ,
| (20) |
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См∙см2/моль;  – удельная электрическая проводимость, См/см.
– удельная электрическая проводимость, См/см.
Поскольку электрическая проводимость объема раствора электролита определяется количеством в этом объеме ионов, переносящих электричество, и скоростью их миграции, для молярной проводимости справедливо соотношение:
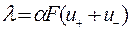 , ,
| (21) |
где u+, u– – абсолютные скорости движения ионов; α – степень диссоциации электролита; F – число Фарадея, т. е. количество электричества, которое несет
1 моль однозарядных катионов и анионов:
 , ,
| (22) |
где NA = 6 ∙ 1023 – число Авогадро, e = 16 ∙ 10–20 Кл – заряд электрона.
При разбавлении раствора молярная электрическая проводимость как сильных, так и слабых электролитов возрастает: для слабых электролитов – вследствие увеличения степени диссоциации (α), для сильных – в результате повышения абсолютной скорости движения ионов (u+, u–).
Предельное значение λ°, отвечающее молярной электрической проводимости гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами, может быть выражено соотношением:
|
|
|
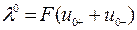 . .
| (23) |
Произведения F ∙ u 0 + = λ0+ и F∙u 0 – = λ 0– называются предельными молярными проводимостями, или предельными подвижностями катионов и анионов.
Отсюда
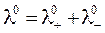 . .
| (24) |
Молярная электрическая проводимость электролита при бесконечном разбавлении (λ0) равна сумме предельных подвижностей анионов и катионов.
Это соотношение установлено Кольраушем и называется законом независимого движения ионов.
Предельная подвижность ионов зависит только от природы растворителя и температуры; для многих ионов эта величина экспериментально определена и приведена в справочниках.
Характер зависимости молярной электрической проводимости от кон-центрации (рис. 2) для сильных и слабых электролитов различен, поскольку влияние концентрации обусловлено разными причинами.
Слабые электролиты диссоциируют на ионы частично (органические кислоты, вода, аммиак, сероводород). Полнота диссоциации слабого электролита количественно характеризуется степенью диссоциацииα – отношение числа молекул, распавшихся на ионы (Nр), к общему числу молекул этого электролита, введенных в раствор (N о):
| α = Np / N o. | (58) |
Степень диссоциации α выражают в долях единицы или процентах. Степень диссоциации электролита зависит от концентрации, температуры раствора, характера растворителя, присутствия в растворе одноименных ионов.
Зависимость между степенью диссоциации α, концентрацией С и константой диссоциации К Д электролита выражается законом разведения Оствальда:
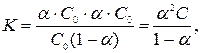
| (59) |
где С 0 – концентрация кислоты до диссоциации, α – степень диссоциации кислоты в растворе.
Зная значения молярной электропроводности при данном и при бесконечном разведениях, можно вычислить степень диссоциации по формуле Аррениуса:
| α = λ / λ∞. | (60) |
|
|
|
Для уксусной кислоты К Д = 1,85 ∙ 10–5.
Приборы и реактивы: кондуктометр, 0,02 н. раствор KCl, 0,1 н. раствор CH3COOH, дистиллированная вода.
Порядок выполнения работы
В сосуд для электропроводности наливают 40 мл раствора хлорида калия, измеряют электропроводность, затем выливают раствор KCl. Вливают 40 мл раствора уксусной кислоты, измеряют его электропроводность. С помощью бюретки отливают из сосуда 20 мл уксусной кислоты и вливают в сосуд
20 мл воды, повторяют 5 раз, измеряя при этом электропроводность раствора. Полученные данные записывают в таблицу:
Таблица 1
Опытные и расчетные данные константы диссоциации слабой кислоты
| Концентра- ция раствора, моль/л | Общая электро-проводность, мкСм | Сопро- тивление сосуда | XC ∙ 10–4 | λ C | α C | K дис |
| 0,1 | ||||||
| 0,05 | ||||||
| 0,025 | ||||||
| 0,0125 | ||||||
| 0,00625 |
|
|
|


