 |
Механизм реакции. Понятие элементарной стадии. Молекулярность.
|
|
|
|
Механизм реакции – детальное ее описание с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей, изменения энергии химической системы на всем пути ее перехода из исходного в конечное состояние.
Элементарный акт химической реакции - это наиболее простое химическое превращение. Например, в реакции  разрывается одна связь O-O и образуется одна связь O-H. Совокупность однотипных элементарных актов называется элементарной реакцией или элементарной стадией реакции. В элементарной реакции, как правило, разрывается или образуется не более одной-двух связей между атомами.
разрывается одна связь O-O и образуется одна связь O-H. Совокупность однотипных элементарных актов называется элементарной реакцией или элементарной стадией реакции. В элементарной реакции, как правило, разрывается или образуется не более одной-двух связей между атомами.
Молекулярность элементарной реакции – число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
В зависимости от числа молекул, участвующих в элементарной реакции, она может быть мономолекулярной, бимолекулярной или тримолекулярной.
Мономолекулярные реакции – реакции, в которых происходит химическое превращение одной частицы (изомеризация, диссоциация и т. д.), например, I2 ® 2I
Бимолекулярные реакции – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных): H2 + I2 ® 2HI
Тримолекулярные реакции – реакции, элементарный акт которых осуществляется при столкновении трех частиц: 2NO + Cl2 ® 2NOCl
Элементарные реакции более высокой молекулярности не наблюдаются ввиду малой статистической вероятности одновременного столкновения множества частиц. Поэтому реакции с участием более чем трех частиц всегда не элементарные
По механизму все химические реакции можно разделить на простые и сложные.
|
|
|
Простые реакции протекают в одну стадию и называются одностадийными или элементарными. Таких реакций известно достаточно мало, например, реакции диссоциации H2 ↔ 2H, взаимодействия монооксида азота с водородом
2NO + H2 → N2O + H2O
Большинство реакций является сложными, многостадийными. Последовательные, параллельные, последовательно-параллельные, цепные и т.д.
1. последовательные A + B → C → D → E, где C и D – промежуточные продукты реакции.
Например, реакция 2N2O5 → 4NO2 + O2 протекает через последовательные стадии:
N2O5 ↔ NO2 + NO3 быстрая
NO3 → NO + O2 медленная
NO + NO3 ↔ 2NO2 быстрая
Скорость последовательной реакции определяется скоростью самой медленной стадии, называемой лимитирующей.
2. параллельные D ← A + B → C, реакция между веществами A и B может приводить к образованию разных продуктов D и C.
Например, реакция разложения гидразина:
N2H4 → N2 + 2H2
3N2H4 → 4NH3 + N2
Скорость реакции рассчитывается как сумма скоростей уменьшения концентрации исходного реагента.
3. цепные реакции в ходе которых возникают особые активные частицы – химические радикалы – которые самовоспроизводятся в элементарных актах.
Например, реакция окисления кислорода водородом записывается общей формулой:
2H2 + O2 → 2H2O
В реальности это цепная реакция, механизм которой можно описать следующим образом:
1. Зарождение цепи – образование активных частиц в результате воздействия светом, теплом, высокой энергией: 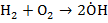
2. Рост цепи – взаимодействие активных частиц с молекулами исходных веществ, сопровождающееся образованием продуктов реакции и новых активных частиц. Звено цепи повторяется многократно:
 продолжение цепи
продолжение цепи
 разветвление цепи
разветвление цепи
 продолжение цепи
продолжение цепи
3. Обрыв цепи, вызванный исчезновением, дезактивацией или израсходованием активных частиц.
|
|
|
|
|
|


