 |
Термодинамические величины
|
|
|
|
Термодинамическими величинами называют физические величины, применяемые при описании состояний и процессов в термодинамических системах.
Термодинамика рассматривает эти величины как некоторые макроскопические параметры и функции, присущие системе, но не связанные с её микроскопическим устройством. Вопросы микроскопического устройства изучает статистическая физика.
Функции состояния
Функции состояния зависят только от текущего состояния системы и не зависят от пути, по которому система пришла в это состояние.
Функции состояния в термодинамике включают:
· температуру,
· давление,
· объём,
· энтропию,
а также термодинамические потенциалы.
В зависимости от выбранной модели некоторые из этих величин, строго говоря, могут быть не функциями, а независимыми переменными.
Эти величины не являются независимыми. Связь между термодинамическими параметрами для конкретной системы называется уравнением состояния.
В случае, если известно каноническое уравнение состояния, задание любой пары параметров из следующих:
· энтропия и объём,
· энтропия и давление,
· температура и объём,
· температура и давление,
позволяет вычислить остальные два параметра.
Функции процесса
Функции процесса зависят не только от текущего состояния системы, но также и от пути, по которому система пришла в данное состояние.
Функции процесса в термодинамике включают:
· количество теплоты и
· термодинамическую работу.
Эти величины, однако, могут быть «превращены» в функции состояния с помощью интегрирующего множителя:
· 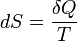 , где
, где  (энтропия) — функция состояния.
(энтропия) — функция состояния.
·  , где
, где 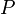 (давление) и
(давление) и  (объём) — функции состояния.
(объём) — функции состояния.
22 вопрос
Химическая реакция – превращение одного или нескольких исходных веществ в другие по химическому составу или строению вещества.
|
|
|
По сравнению с ядерными реакциями общее число атомов и изотопный состав химических элементов при химических реакциях неизменны.
Виды химических реакций:
1) смешение или физический контакт реагентов;
2) нагревание;
3) катализ;
4) фотохимические реакции (с участием света);
5) электродные процессы;
6) механохимические реакции;
7) радиационно-химические реакции;
8) плазмохимические реакции.
Основные типы химических реакций:
1) соединения: 2Cu + O2 = 2CuO;
2) разложения: 2HgO = 2Hg + O2;
3) замещения: Fe + CuSO4 = FeSO4 + Cu;
4) обмена: NaCl + H2SO4 = НСl + NaHSO4.
Химические реакции характеризуются физическими проявлениями:
1) поглощение и выделение энергии;
2) изменение агрегатного состояния реагентов;
3) изменение окраски реакционной смеси и др.
Выделение или поглощение энергии происходит в виде теплоты. Это позволяет судить о наличии в веществах определенного количества некоторой энергии (внутренней энергией реакции).
При химических реакциях происходит освобождение части энергии, содержащейся в веществах, это носит название теплового эффекта реакции, по которому можно судить об изменении количества внутренней энергии вещества.
У ряда химических реакций можно наблюдать поглощение или выделение лучистой энергии. В этих случаях внутренняя энергия через теплоту превращается в излучение (горение). Существуют также процессы в которых внутренняя энергия сразу превращается в лучистую (лю-минисценция).
В химических реакциях, протекающих с взрывом, внутренняя энергия превращается в механическую, причем частично сразу, частично переходя изначально в теплоту.
Во время химических реакций происходит взаимное превращение энергий – внутренней энергии веществ в тепловую, лучистую, электрическую и механическую, и наоборот.
|
|
|
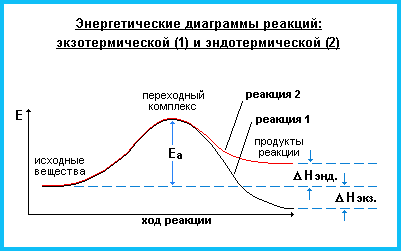
Экзотермические химические реакции характеризуются выделением энергии во внешнюю среду. Эндотермические – поглощением энергии.
В физических процессах вещества не изменяют своих свойств, может измениться внешняя форма или агрегатное состояние. В химических процессах образуются новые вещества с другими свойствами. При ядерных реакциях в атомах обязательно происходят трансформации электронной оболочки.
Тепловой эффект реакции
В ходе реакции происходит разрыв связей в исходных веществах и образование новых связей в продуктах реакции. Поскольку образование связи идет с выделением, а ее разрыв - с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Энергия выделяется, если рвущиеся связи в исходных веществах менее прочны, чем связи, образующиеся в продуктах реакции, в противном случае - энергия поглощается. Обычно энергия выделяется и поглощается в форме теплоты, т.е. химическая форма энергии преобразуется в тепловую. Таким образом, химические реакции сопровождаются тепловыми эффектами.
- Тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
Тепловой эффект обозначается символами Q или ΔH (Q = –ΔH). Его величина соответствует разности между энергиями исходного и конечного состояний реакции:
ΔH = Hкон. – Hисх. = Eкон. – Eисх.
- Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q > 0, ΔH < 0) и называются экзотермическими.
- Реакции, которые идут с поглощением теплоты из окружающей среды (Q < 0, ΔH > 0), т.е. с отрицательным тепловым эффектом, являются эндотермическими.
ВНУТРЕННЯЯ ЭНЕРГИЯ термодинамич. ф-ция состояния системы, ее энергия, определяемая внутр. состоянием. Внутренняя энергия складывается в осн. из кинетич. энергии движения частиц (атомов, молекул, ионов, электронов) и энергии взаимод. между ними (внутри- и межмолекулярной). На внутреннюю энергию влияет изменение внутр. состояния системы под действием внеш. поля; во внутреннюю энергию входит, в частности, энергия, связанная с поляризацией диэлектрика во внеш. электрич. поле и намагничиваниемпарамагнетика во внеш. магн. поле. Кинетич. энергия системы как целого и потенциальная энергия, обусловленная пространств. расположением системы, во внутреннюю энергию не включаются. В термодинамике определяется лишь изменение внутренней энергии в разл. процессах. Поэтому внутреннюю энергию задают с точностью до нек-рого постоянного слагаемого, зависящего от энергии, принятой за нуль отсчета.
|
|
|
Внутренняя энергия U как ф-ция состояния вводится первым началом термодинамики, согласно к-рому разность между теплотой Q, переданной системе, и работой W, совершаемой системой, зависит только от начального и конечного состояний системы и не зависит от пути перехода, т.е. представляет изменение ф-ции состояния 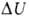

где U1 и U2 - внутренняя энергия системы в начальном и конечном состояниях соответственно. Ур-ние (1) выражает закон сохранения энергии в применении к термодинамич. процессам, т. е. процессам, в к-рых происходит передача теплоты. Для циклич. процесса, возвращающего систему в начальное состояние, 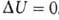 . В изохорных процессах, т.е. процессах при постоянном объеме, система не совершает работы за счет расширения, W=0 и теплота, переданная системе, равна приращению внутренней энергии: Qv=
. В изохорных процессах, т.е. процессах при постоянном объеме, система не совершает работы за счет расширения, W=0 и теплота, переданная системе, равна приращению внутренней энергии: Qv=  . Для адиабатич. процессов, когда Q = 0,
. Для адиабатич. процессов, когда Q = 0,  = - W.
= - W.
Внутренняя энергия системы как ф-ция ее энтропии S, объема V и числа молей mi i-того компонента представляет собойтермодинамический потенциал. Это является следствием первого и второго начал термодинамики и выражается соотношением:
 "
"
где Т - абс. т-ра, р-давление,  -хим. потенциал i-того компонента. Знак равенства относится к равновесным процессам, знак неравенства-к неравновесным. Для системы с заданными значениями S, V, mi (закрытая система в жесткой адиабатной оболочке) внутренняя энергия при равновесии минимальна. Убыль внутренней энергии в обратимых процессах при постоянных V и S равна макс. полезной работе (см. Максимальная работа реакции).
-хим. потенциал i-того компонента. Знак равенства относится к равновесным процессам, знак неравенства-к неравновесным. Для системы с заданными значениями S, V, mi (закрытая система в жесткой адиабатной оболочке) внутренняя энергия при равновесии минимальна. Убыль внутренней энергии в обратимых процессах при постоянных V и S равна макс. полезной работе (см. Максимальная работа реакции).
Зависимость внутренней энергии равновесной системы от т-ры и объема U =f(T, V)наз. калорическим уравнением состояния. Производная внутренней энергии по т-ре при постоянном объеме равна изохорной теплоемкости:
|
|
|

Внутренняя энергия идеального газа от объема не зависит и определяется только т-рой.
Экспериментально определяют значение внутренней энергии в-ва, отсчитываемое от ее значения при абс. нуле т-ры. Определение внутренней энергии требует данных о теплоемкости СV(Т), теплотах фазовых переходов, об ур-нии состояния. Изменение внутренней энергии при хим. р-циях (в частности, стандартная внутренняя энергия образования в-ва) определяется по данным о тепловых эффектах р-ций, а также по спектральным данным. Теоретич. расчет внутренней энергии осуществляется методами статистич.термодинамики, к-рая определяет внутреннюю энергию как среднюю энергию системы в заданных условиях изоляции (напр., при заданных Т, V, mi). Внутренняя энергия одноатомного идеального газа складывается из средней энергии поступат. движения молекул и средней энергии возбужденных электронных состояний; для двух- и многоатомных газов к этому значению добавляется также средняя энергия вращения молекул и их колебаний около положения равновесия. Внутренняя энергия 1 моля одноатомного идеального газа при т-рах порядка сотен К составляет 3RT/2, где R-газовая постоянная; она сводится к средней энергии поступат. движения молекул. Для двухатомного газа мольное значение внутренней энергии-ок. 5RT/2 (сумма поступат. и вращат. вкладов). Указанные значения отвечают закону равнораспределения энергии для названных видов движения и вытекают из законов классич. статистич. механики. Расчет колебат. и электронного вкладов во внутреннюю энергию, а также вращат. вклада при низких т-рах требует учета квантовомех. закономерностей. Внутренняя энергия реальных систем включает помимо вкладов, учитываемых для идеального газа, также среднюю энергию межмолекулярных взаимодействии.
|
|
|


