 |
III. Свойства многоатомных спиртов
|
|
|
|
ПОЛУЧЕНИЕ

3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α - аминокислоты белков.
Аминокислоты, как амфотерные соединения, сочетают свойства карбоновых кислот и органических оснований.
Как кислоты, они взаимодействуют с основаниями, образуя соль и воду:

Как карбоновые кислоты, они взаимодействуют со спиртами, образуя сложные эфиры:

Как основания, аминокислоты реагируют с кислотами, образуя соли:

Важнейшим свойством аминокислот является их способность вступать в реакцию поликонденсации друг с другом:
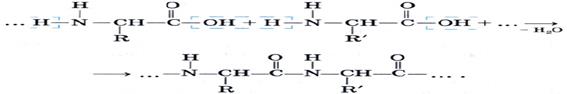
51. Превращения аминокислот при нагревании. α-Аминокислоты, а еще легче их эфиры, при нагревании образуют циклические пептиды— дикетопиперазины:

β-Аминокислоты при нагревании образуют α,β-ненасыщенные кислоты с отщеплением аминогруппы и водорода от соседних атомов углерода:

γ-, δ- и ε-Аминокислоты, как и соответствующие оксикислоты, легко отщепляют воду и циклизуются, образуя внутренние амиды — лактамы:

52. Углеводы можно определить как альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти производные.
Согласно принятой в настоящее время классификации, углеводы подразделяются на три основные группы:моносахариды, олигосахариды и полисахариды.

Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная группа находится в конце цепи, то моносахаридпредставляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахаридявляется кетоном и называется кетозой.
|
|
|
Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы трехатомного спирта – глицерола – образуется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к образованию диоксиацетона (кетоза).

при написании структурных формул по Хеуорсу гидроксильная группа при С-1 должна быть расположена ниже плоскости кольца в α-форме и выше – в β-форме:

1. Основным способом получения моносахаридов, имеющим практическое значения, является гидролиз ди- и полисахароидов:

2. Альдольная конденсация формальдегида - первый синтез сахаров был произведен еще А. М. Бутлеровым, который в качестве катализатора альдольной конденсации использовал гидроксид кальция:
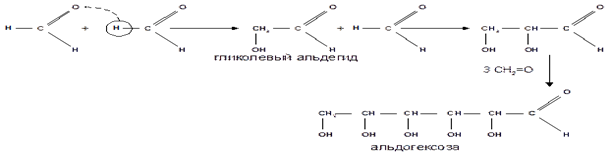
Полученная альдогексоза оптически недеятельна и представляет собой рацемическую смесь Д - и L - альдогексоз.
3. Присоединение синильной кислоты (оксинитрильный синтез) используется для удлинения цепи моносахаридов и перехода от низших моносахаридов к высшим. Этот метод был разработан более ста лет назад (Киллани, Фишер), но до сих пор остается важнейшим методом наращивания цепи моносахаридов, несмотря на свою многостадийность:

Первая стадия - получение оксинитрилов приводит к смеси диастереоизомеров. В результате гидролиза образуется смесь диастереоизомерных амидов, которые омыляют затем гидроксидом бария с образованием смеси диастереомерных солей. Разделение двух диастереомеров проводят на этой стадии методом дробной кристаллизации солей, после чего каждую соль переводят в кислоту. Кислоты нагреванием с разбавленной серной кислотой превращают в соответствующие d-лактоны, которые восстанавливают амальгамой натрия в моносахариды: Д- глюкозу и Д- маннозу, содержащие на один углеродный атом больше, чем исходная Д - арабиноза.
|
|
|
4. Метод укорачивания цепи основан на окислении моносахаридов, содержащих на один атом углерода больше, чем в нужном моносахариде. Например, при окислении альдогексозы пероксидом водорода в присутствии ацетата железа (III) образуется альдоновая кислота, которая затем декарбоксилируется с образованием соответствующей альдопентозы:
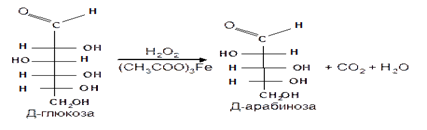
Механизм этой реакции, называемой распад по Руффу, остался невыясненным.
53. Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:

3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
4. Лимоннокислое брожение:
2C6H12O6 + 3O2 → 2C6H8O7 + 4H2O
II. Свойства альдегидов
1. Реакция серебряного зеркала:
СH2OH(CHOH)4-COH + Ag2O t.NH3 → СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH - глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
III. Свойства многоатомных спиртов
|
|
|


