 |
Практическое применение фагов
|
|
|
|
Применение фагов основано на их строгой специфичности и способности разрушать микробные клетки или вступать с ними в симбиоз.
Фагопрофилактика и фаготерапия - предупреждение и лечение инфекций с помощью фагов основаны на том, что, встречая в организме больного возбудителя болезни, фаг уничтожает его. В настоящее время фаги широко применяют при лечении и профилактике стафилококковых и стрептококковых поражений, даже таких, которые не поддаются действию антибиотиков, а также холеры, чумы и ряда других инфекций, например инфекций, вызванных кишечной палочкой и протеем.
Фагодиагностика включает:
а) идентификацию выделенных культур с помощью известных (диагностических) фагов. Культура соответствует тому фагу, который ее лизировал. Например, если лизис вызвал холерный фаг, то это культура холерного вибриона. Строгая специфичность типовых фагов дает возможность типировать варианты внутри вида (фаговары). Фаготипирование имеет большое значение в эпидемиологии, так как позволяет установить источник инфекции и решить ряд других вопросов (эпидемиологическое маркирование);
б) определение неизвестного фага по тест-культуре микробов. Если фаг лизирует культуру возбудителя дизентерии, то это дизентерийный фаг;
в) ускоренный метод диагностики с помощью реакции нарастания титра фага РНТФ не требует выделения чистой культуры возбудителя. Исследуемый материал (от больного или из объектов внешней среды) и индикаторный фаг, титр которого строго установлен, вносят в бульон. После инкубации в термостате определяют титр фага по Грациа. Увеличение титра (числа корпускул фага) в 5 раз и более говорит о том, что в исследуемом материале есть соответствующие возбудители, в которых фаг размножился.
|
|
|
Умеренные фаги широко применяют при решении кардинальных вопросов биологии. С их помощью изучен генетический код, достигнуты большие успехи в генной инженерии, их используют для изучения опухолевого роста, как фактор изменчивости микроорганизмов и в других исследованиях. Так как лизогенные культуры в отличие от "здоровых" чувствительны к радиации, они служат для определения надежности защиты космических кораблей от космических лучей: при ненадежной защите профаг переходит в вирулентную форму и лизирует культуру.
Препараты фагов
При производственном получении препаратов фага пользуются хорошо изученными штаммами микроорганизмов и фагов, которые обычно выращивают в реакторах, что позволяет получать большие количества фаголизата.
Фаги выпускают в жидком виде (ампулы и флаконы), в таблетках и свечах. Таблетки фагов, предназначенные для применения через рот, покрыты кислотоустойчивой оболочкой, защищающей фаги от действия соляной кислоты желудочного сока.
Все препараты фагов подлежат обязательному контролю на отсутствие посторонней флоры, безвредность и активность (титр), который осуществляется на выпускающем их производстве. Выборочный контроль производят в Государственном НИИ стандартизации и контроля медицинс-ких биологических препаратов им. Л. А. Тарасевича. Выпускаемый фаг снабжен этикеткой, на которой указано: учреждение, его выпускающее, название фага, серия, номер контроля и срок годности. Каждая упаковка снабжена наставлением по применению и хранению фага.  Рис 13.3 Жидкий Пиобактериофаг.
Рис 13.3 Жидкий Пиобактериофаг.
| ГЕНЕТИКА МИКРООРГАНИЗМОВ. Горизонтальная передача генетической информации у бактерий осуществляется путем генетических рекомбинаций. Генетическая рекомбинация — взаимодействие между двумя различными геномами, которое приводит к образованию рекомбинаций ДНК и формированию дочернего генома, сочетающего гены обоих родителей. Типы генетических рекомбинации: – гомологичная — в процессе разрыва и воссоединения ДНК происходит обмен между участками ДНК, обладающими высокой степенью гомологии; – сайт-специфическая — происходит только в определенных участках генома и не требует высокой степени гомологии ДНК (напр., включение плазмиды в хромосому бактерии). В процессе рекомбинации бактерии условно делятся на клетки-доноры, которые передают генетический материал, и клетки-реципиенты, которые этот материал воспринимают. В клетку-реципиент проникает не вся, а только часть хромосомы клетки-донора, т.е. один или несколько генов. Образуется один рекомбинант, генотип которого представлен в основном генотипом реципиента с включением фрагментов хромосомы донора. Рекомбинационная изменчивость у бактерий происходит в результате включения в ДНК реципиентной клетки участка ДНК донорской клетки путем трансформации, трансдукции, конъюгации. Конъюгация— перенос генетического материала при непосредственном контакте донорской и реципиентной клеток с помощью конъюгативных пилей (рис. 13.4, I). Контролируется tra (transfer) опероном. Необходимым условием конъюгации является наличие в клетке-доноре трансмиссивной конъюгативной F–плазмиды. Клетки-доноры, обладающие F–плазмидой, обозначаются как F+–клетки. Клетки-реципиенты, не имеющие F–плазмиды, — F-–клетки. Соотношение в бактериальной популяции F+и F-–клеток 1:10-5. Трансмиссивная плазмида кодирует половые пили, образующие конъюгационную трубочку между клеткой-донором и клеткой-реципиентом, по которой плазмидная ДНК передается из клетки-донора в клетку-реципиент. Передача генетического материала при конъюгации начинается с расщепления ДНК в районе локализации F–плазмиды. Одна нить донорской ДНК передается через конъюгационный мостик в реципиентную F-–клетку, достраивается комплементарная нить до образования двунитевой структуры. Другая нить донорской ДНК остается в клетке, т.е. донор сохраняет свое генетическое постоянство. Если переданная F–плазмида сохраняется в реципиентной клетке в автономном состоянии, то донор и реципиент меняются полами. Если переданная донорская ДНК рекомбинирует с гомологичным участком реципиентной ДНК с образованием стабильной генетической структуры, то клетка-реципиент получает донорские свойства. Донорские клетки, имеющие встроенную в хромосому F–плазмиду, называются Hfr–клетками (англ. High frequency of recombination — высокая частота рекомбинаций). |
|
|
|
|
|
|
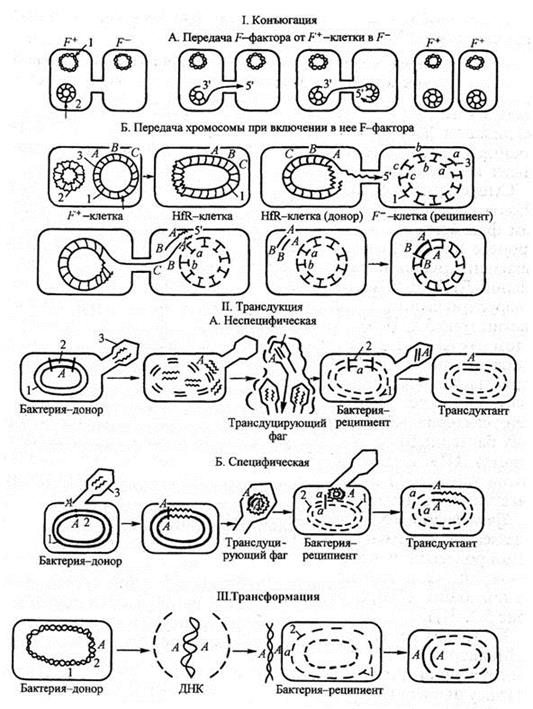
Рис. 13.4. Передача генетической информации у бактерий
I Конъюгация: 1 — бактериальная хромосома; 2 — F–фактор; 3 — гены, участвующие в рекомбинации; АВС — генотип донора; abc — генотип реципиента.
II Трансдукция: 1 — бактериальная хромосома; 2 — гены, участвующие в рекомбинации; А — ген, переносимый фагом; а — генотип реципиента; 3 — фаг.
III Трансформация: 1 — бактериальная хромосома; 2 — гены, участвующие в рекомбинации: А — генотип донора; а — генотип реципиента.
Для полового процесса бактерий нехарактерна репродуктивная изоляция: процесс конъюгации может происходить между родами одного семейства (напр., эшерихиями и сальмонеллами, сальмонеллами и шигеллами).
| Трансдукция— передача генетического материала от бактерии-донора к бактерии-реципиенту с помощью фаговой ДНК (рис. 13.4,II). У бактерий обнаружены бактериофаги двух типов — вирулентные и умеренные. Вирулентные бактериофаги после размножения в клетках бактерий приводят к их лизису. Они существуют в вегетативном (размножение в клетках бактерий) или в зрелом (метаболически инертное состояние вне бактериальных клеток) состоянии. Умеренные бактериофаги — факторы изменчивости бактерий, которые напоминают по своим свойствам плазмиды бактерий. Кроме вегетативного и инертного состояния, они могут быть также в состоянии профага (интегрированное с хромосомой состояние) и реплицироваться вместе с хромосомой бактерии. Бактерии, несущие профаг, называют лизогенными (от греч. lysis — растворение — способность фага лизировать бактерии). Эти бактерии, содержащие в своих хромосомах генетический материал фага, не продуцируют инфекционных фаговых частиц, хотя и сохраняют эту способность. Она может проявиться в определенных условиях, когда произойдет индукция профага. При индукции профаг вырезается из хромосомы бактерии, переходит в вегетативное состояние и размножается. В клетке образуются зрелые фаговые частицы, которые высвобождаются в окружающую среду после ее лизиса. Индукцию профага можно вызвать различными физическими или химическими агентами. Наиболее распространенным индуктором является УФО лизогенных клеток. Лизогения широко распространена среди бактерий и актиномицетов. Фенотипическим проявлением лизогении может быть изменение наследственных признаков микроорганизмов: типа колоний, антигенных и других свойств. Лизогенные клетки обладают селективными преимуществами по сравнению с нелизогенными, они резистентны к гомологичным суперинфицирующим фагам. Изменчивость лизогенных бактерий может быть связана: – с приобретением генов, переносимых фагами от их предыдущих хозяев (бактерий-доноров). В процессе репликации фага внутри бактерий фрагмент бактериальной ДНК проникает в фаговую частицу и переносится вместе с ней в бактерию-реципиент. В результате включения в хромосому фаговой ДНК происходит фаговая (лизогенная) конверсия — изменение свойств бактерий. Так как трансдуцируются небольшие фрагменты ДНК, то вероятность рекомбинации, затрагивающей определенный признак, очень мала и составляет 10-6–10-8. Напр., дифтерийная палочка без умеренного бактериофага не выделяет экзотоксин и не вызывает заболеваний. Попав в клетку-рецепиент, умеренный бактериофаг, несущий ген токсигенности, интегрируется с хромосомой и изменяет свойства клетки (наделяет ее способностью продуцировать экзотоксин и вызывать дифтерию). Поэтому при выявлении носительства нетоксигенных штаммов проводится санация носителей с применением антибиотиков; – с экспрессией «молчащих» генов бактерий-реципиентов. В последнем случае фаговая ДНК, встраиваясь вблизи поврежденного промотора, заменяет его. При этом у бактерии-реципиента появляются новые признаки. Типы трансдукции. 1. Общая (неспецифическая) трансдукция — перенос вирулентным бактериофагом фрагмента любой части бактериальной хромосомы и возможность передачи любого признака, так как в клетки-реципиенты могут быть внесены практически любые гены. В инфицированной вирулентным бактериофагом клетке в ходе сборки дочерней популяции в головки некоторых фагов может проникнуть фрагмент бактериальной ДНК (вместе с вирусной ДНК либо вместо нее). Это происходит потому, что после фаговой инфекции бактериальная ДНК фрагментируется и кусочек бактериальной ДНК того же размера, что и фаговая ДНК, проникает в вирусную частицу с частотой 1 на 1000 фаговых частиц. При общей трансдукции участок донорской ДНК встраивается в нуклеоид, при бинарном делении передается обеим клеткам. 2. Абортивная трансдукция — внесенный фрагмент ДНК донора не встраивается в хромосому реципиента, а остается в цитоплазме и там самостоятельно функционирует. При бинарном делении остается лишь у одной клетки и затем теряется в потомстве. 3. Специфическая трансдукция наблюдается, когда фаговая ДНК интегрирует в бактерию с образованием профага. При исключении ДНК фага из бактериальной хромосомы в результате случайного процесса захватывается прилегающий к месту включения фаговой ДНК фрагмент бактериальной хромосомы. Так как большинство умеренных фагов интегрируют в бактериальную ДНК в специфических участках, для таких бактериофагов характерен перенос в клетку-реципиент определенного участка бактериальной ДНК донора. Специфическая трансдукция может служить механизмом переноса вирулентных генов среди бактерий при условии, что эти гены локализованы в непосредственной близости от мест интеграции профага. |
|
|
|
|
|
|
Трансформация — передача свободных фрагментов ДНК (плазмидной или хромосомной) от донорской клетки к реципиентной без их непосредственного контакта и образование на этой основе рекомбинанта (рис. 13.4, III). При трансформации среди бактериальных популяций могут распространяться гены, кодирующие факторы патогенности, резистентность к антибиотикам, однако в обмене генетической информацией трансформация играет незначительную роль.
Впервые явление трансформации было обнаружено на пневмококках при изучении переноса наследственных признаков от капсульных вирулентных пневмококков, убитых при нагревании, к живым бескапсульным клеткам пневмококков, не обладающим вирулентностью. Активным началом в этом процессе являлась ДНК.
Трансформация может произвольно происходить в природе у некоторых видов бактерий, чаще у Грам+, причем не только в пределах одного вида, но и между разными видами. Однако чем дальше отстоит один вид от другого в таксономическом отношении, тем меньше частота межвидовой трансформации.
Типы трансформации.
1. Абортивная трансформация —как правило, любая чужеродная ДНК, попадающая в бактериальную клетку, расщепляется рестрикционными эндонуклеазами.
2. Интегративная трансформация — чужеродная ДНК интегрируется в геном бактерии.
После поглощения ДНК клетками начинаются ее преобразования, предшествующие рекомбинации с хромосомой: разрывы ДНК на более короткие фрагменты и расплетание двунитевой ДНК на однонитевые участки. Затем такие нити образуют синапс с гомологичными участками хромосомы реципиента и рекомбинируют с ними, замещая одну из нитей ДНК хромосомы. В момент замещения хромосома в определенном участке имеет одну свою и одну чужую нить ДНК. При последующей репликации происходит образование двух новых нитей на своей и чужой матрице. Отражением этого является то, что в колонии, выросшей из клетки-трансформанта, содержится обычно смесь исходных реципиентных клеток и рекомбинантных клеток, наследовавших признаки обоих родительских штаммов.
Трансформация используется для картирования хромосом, поскольку трансформированные клетки включают различные фрагменты ДНК. Определение частоты одновременного приобретения двух заданных характеристик (чем ближе расположены гены, тем более вероятно, что они оба включатся в один и тот же участок ДНК) дает информацию о взаиморасположении соответствующих генов в хромосоме. При трансформации клетка поглощает менее 1% всего генома донора. Поэтому генетические карты, построенные посредством трансформации, показывают последовательность расположения генов лишь на небольших участках бактериальных хромосом.
К трансформации примыкают явления, в основе которых также лежит поглощение ДНК бактериальной клеткой. Одно из них — трансфекция, когда клетки поглощают искусственно выделенную фаговую ДНК. В результате в клетке начинается развитие фага с последующим лизисом клетки и освобождением зрелых фаговых частиц. Таким же путем можно ввести в бактерию плазмидную ДНК, передать рекомбинантную ДНК, сконструированную генно-инженерными методами, и передать в живую бактериальную клетку ДНК разного происхождения. Перенос экстрагированной ДНК является основным методом генной инженерии, используемым при конструировании рекомбинантных штаммов с заданным геномом.
Опыт по изучению феномена роения Proteus mirabilis на питательном агаре и на агаре с 1% сухой желчью в чашках Петри.
Выявление фенотипической изменчивости можно провести в опыте с феноменом роения у Proteus mirabilis. Сначала изучают колонии бактерий рода Proteus, выросшие на питательном агаре в чашке Петри через 24 ч после посева разведенной культуры. Отмечают, что все колонии протея окружены «зоной роения». Пересевают колонии петлей на поверхность агара с 1% желчью в чашках Петри и инкубируют при 370С 18-24 ч. Все колонии протея, выросшие на питательном агаре с желчью, не имеют «зон роения». Вновь пересевают колонию в чашку Петри с питательным агаром и инкубируют при 370С 18-24 ч. Наблюдают, что все колонии, выросшие на питательном агаре, окружены «зоной роения».
Изменение фенотипа протея на питательной среде с желчью (утрату роения) следует считать модификацией, т.к. налицо все три ее отличительных признака: определенность (связь отсутствия роения с определенным фактором – желчью), общность изменений (утрата роения наблюдается у всех колоний популяции), обратимость (при отсутствии желчи в питательной среде восстанавливается исходный фенотип).


 | |||||
 | |||||
 | |||||


 |
Рис.13.5. Феномен роения Proteus mirabilis на чашке Петри с МПА
Рис. 13.6. Феномен роения отсутствует на чашке Петри с МПА и 1% желчью
|
|
|


