 |
Реакции гидроксилирования и карбоксилирования.
|
|
|
|
С помощью этих реакций в молекулу органического соединения вводится дополнительная гидроксильная или карбоксильная группы. Реакции протекают при участии соответствующих ферментов и приводят к образованию модифицированных аминокислот. Эти реакции не имеют аналогов в химии in vitro.
Гидроксилированием называют введение в молекулу органического соединения гидроксильной группы. Так, гидроксилирование фенилаланина приводит к образованию тирозина:
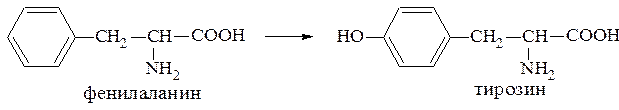
Отсутствие в организме фермента, катализирующего эту реакцию, приводит к тяжелому заболеванию - фенилкетонурии.
Значительный интерес представляет реакция гидроксилирования пролина:
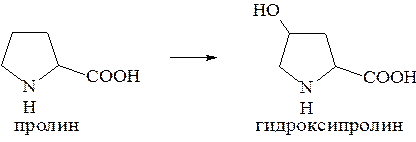
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, которая осуществляется за счет образования водородных связей.
При цинге нарушается гидроксилирование остатков пролина и лизина. В результате образуются менее прочные коллагеновые волокна, что приводит к хрупкости и ломкости кровеносных сосудов.
Карбоксилированием называютвведение в молекулу органического соединения карбоксильной группы. Таким образом получают, например,
γ-карбоксиглутаминовую кислоту:
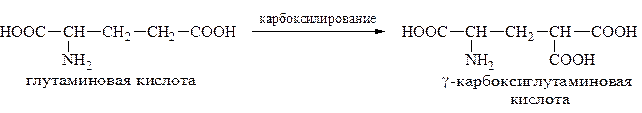
γ-Карбоксиглутаминовая кислота входит в состав белков, участвующих в процессах свертывания крови, так как две близлежащие карбоксильные группы в её структуре способствуют более полному связыванию белковых факторов с ионами кальция:

Нарушение карбоксилирования глутамата приводит к снижению свертываемости крови.
Таким образом, модифицированные аминокислоты, имеющие в своих структурах дополнительные функциональные группы, приобретают свойства, необходимые для выполнения ими специфических функций.
|
|
|
Восстановительное аминирование.
Это реакция превращения α-кетокислот в α-аминокислоты осуществляется в организме при участии восстановленной формы никотинамидадениндинуклеотида (НАД∙Н). Так, продуктом метаболизма углеводов является α-кетоглутаровая кислота, которая в результате ряда реакций превращается в глутаминовую кислоту:
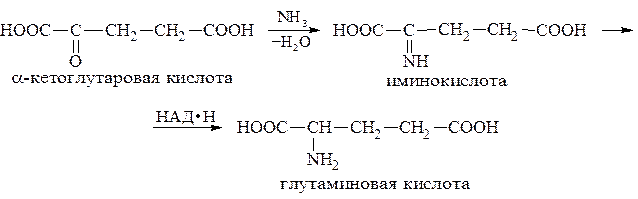
Альдольное расщепление.
Реакция протекает с α-аминокислотами, содержащими гидроксильную группу в β-положении углеводородного радикала.
Рассмотрим, например, реакцию расщепления серина, в результате которой образуются глицин и формальдегид.
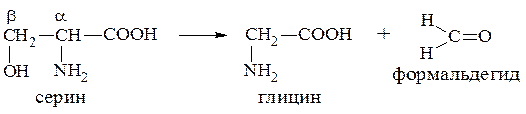
В результате этой реакции расщепляется С-С связь между α- и
β-углеродными атомами. Образующийся формальдегид не выделяется, а связывается с другим коферментом - тетрагидрофолиевой кислотой и в качестве одноуглеродного фрагмента участвует далее в синтезе многих важных соединений.
ПЕПТИДЫ
Полипептиды образуются в результате реакции конденсации, протекающей между аминогруппой одной кислоты и карбоксильной группой другой:
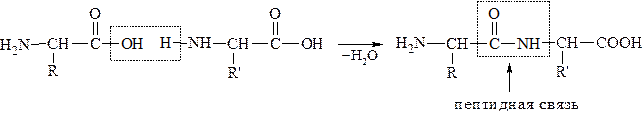
Пептид, образованный двумя аминокислотами, называется дипептид, тремя - трипептид и.т.д. Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами. Часто в названии таких молекул указывают число аминокислот, входящих в состав данного олигопетида: дипептид, трипептид, тетрапептид, октапептид и.т.д.
Пептиды, содержащие более 10 аминокислот, называют полипептидами. А полипептиды, содержащие более 50 аминокислотных остатков, обычно называют белками. Однако такие градации весьма условны: например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном. Гормоны окситоцин и вазопрессин содержат всего по 9 аминокислотных остатков.
Поэтому более удачным следует считать различие, проводимое на уровне структуры полимера, более сложном, чем простая аминокислотная последовательность и количественный состав пептида. Полипептиды представляют собой линейные, довольно гибкие молекулы, а длинные цепи белков свернуты в клубок или иную структуру. Многие белки могут иметь в своем составе группы небелкового характера (простетические группы), связанные с полиамидной цепью.
|
|
|
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот. Например, тетрапептиды сер-гис-про-ала и ала-гис-про-сер - это два разных пептида, несмотря на то, что они имеют одинаковый качественный и количественный состав.
|
|
|


