 |
Квантово-механическая модель атома
|
|
|
|
Строение атома
Периодический закон и периодическая система элементов послужили мощным толчком к исследованиям строения атома, которые изменили представление о законах мироздания и привели к практическому воплощению идеи использования ядерной энергии.
К моменту открытия периодического закона только лишь стали утверждаться представления о молекулах и атомах. Причем атом считался не только наименьшей, но и элементарной (то есть неделимой) частицей. Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. В 1896 г. французский физик А. Беккерель обнаружил, что материалы, содержащие уран, засвечивают в темноте фотопластинку, ионизируют газ, вызывают свечение флюоресцирующих веществ. В дальнейшем выяснилось, что этой способностью обладает не только уран. П. Кюри и Мария Склодовская-Кюри открыли два новых радиоактивных элемента: полоний и радий.
Катодные лучи, открытые В. Круксом и Дж. Стоней в 1891 г. предложил назвать электронами – как элементарные частицы электричества. Дж. Томсон в 1897 г., исследуя поток электронов, пропуская его через электрическое и магнитное поля, установил значение величины е/m – отношение заряда электрона к его массе, что привело ученого Р. Милликена в 1909 г. к установлению величины заряда электрона q = 4,8∙10-10 электростатических единиц, или 1,602∙10-19 Кл (Кулон), а соответственно и к массе электрона –
9,11∙10-31 кг. Условно рассматривают заряд электрона как единицу отрицательного электрического заряда и присваивают ему значение (-1). А.Г. Столетовым было доказано, что электроны входят в состав всех атомов, имеющихся в природе. Атомы электронейтральны, то есть в целом не обладают электрическим зарядом. А это значит, что в состав атомов, кроме электронов должны входить положительные частицы.
|
|
|
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Квантовые числа (К.ч.)
Набор К. ч., исчерпывающе определяющий состояние квантовой системы, называется полным. Совокупность состояний, отвечающих всем возможным значениям К. ч. из полного набора, образует полную систему состояний. Состояние электрона в атоме определяется четырьмя К. ч. соответственно четырём степеням свободы электрона (3 степени свободы связаны с тремя координатами, определяющими пространственное положение электрона, а четвёртая, внутренняя, степень свободы — с его спином). Для атома водорода и водородоподобных атомов эти К. ч., образующие полный набор, следующие.
Главное К. ч. n = 1, 2, 3,... определяет уровни энергии электрона.
Азимутальное (или орбитальное) К. ч. l = 0, 1, 2,..., n — 1 задаёт спектр возможных значений квадрата орбитального момента количества движения электрона: 
Магнитное К. ч. ml характеризует возможные значения проекции Mlz орбитального момента Ml на некоторое, произвольно выбранное, направление (принимаемое за ось z): 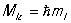 l до + l (всего 2 l + 1 значений).
l до + l (всего 2 l + 1 значений).
Магнитное спиновое К, ч., или просто спиновое К. ч., ms характеризует возможные значения проекции спина электрона и может принимать 2 значения:
ms = ± 1/2.
Задание состояния электрона с помощью К. ч. n, l, ml и ms не учитывает так называемой тонкой структуры энергетических уровней — расщепления уровней с данным n (при n ≥ 2) в результате влияния спина на орбитальное движение электрона.
|
|
|
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
5 Периодический закон и строение атомов. Периодическая система Д.И.Менделеева и их соединений. Окислительно-восстановительные свойства элементов.
ом состоит из ядра и электронной оболочки. Ядро образуют протоны и нейтроны (нуклоны), электронную оболочку – электроны, движущиеся вокруг ядра. Число электронов (Ne) в атоме равно числу протонов в ядре (Np), которое в свою очередь равно заряду ядра (Z) – порядковому номеру элемента в периодической системе. Число нейтронов (Nn) определяется как разность массового
|
|
|
числа атома (А) и заряда ядра.
Ne= Np= Z
Nn= A – Z
Разновидность атомов с определенным значением Z и А называется нуклидом. Для обозначения нуклидов используют символ элемента, к которому присоединяют значения массового числа. При этом слева
от символа элемента внизу указывают заряд ядра (порядковый номер), вверху – массовое число. Например, 2654Fe.
Нуклиды одного и того же элемента, то есть атомы, имеющие одинаковый заряд ядра, но разное массовое число (одинаковое число протонов и разное число нейтронов в ядре), называют изотопами. Нуклиды различных элементов (разное число протонов в ядре) с одинаковым значением массового числа называют изобарами. Нуклиды различных элементов с одинаковым число нейтронов в ядре называют изотонами.
Электроны в электронной оболочке распределены по атомным орбиталям (АО), которые объединяются в энергетические подуровни, подуровни – в уровни.
Графически АО изображают в виде квантовых ячеек (клеточек cили черточек —), а электроны изображают стрелками:
Каждая АО характеризуется набором трех квантовых чисел, четвертое квантовое число описывает собственное движение электронов. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, форма и пространственное расположение которых представлено на рис. 1.
Распределение электронов по энергетическим уровням, подуровням и атомным орбиталям происходит в соответствии с принципом Паули, принципом минимальной энергии, правилом Хунда и правилами Клечковского.
Периодическая система Д.И.Менделеева и их соединений
869 г. Д.И. Менделеевым был открыт периодический закон: "Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов".
|
|
|
Физический смысл периодического закона подтвердило развитие учения о строении атома. В связи с этим произошло уточнение формулировки периодического закона Д.И. Менделеева: "Свойства элементов, а также их соединений находятся в периодической зависимости от величин заряда ядер атомов элементов".
В периодической системе элементы расположены в порядке возрастания зарядов ядер их атомов. Порядковый номер элемента равен заряду ядра атома и соответственно общему количеству электронов этого атома.
Периодическая система – графическое отображение этого закона, таблица, в которой расположены все известные химические элементы (см. прил., табл.15).
Периодическая система элементов состоит из периодов, групп и подгрупп.
Горизонтальные ряды химических элементов в таблице Д.И. Менделеева, в пределах которых последовательно изменяются их химические свойства, называются периодами. Периодическая система содержит 7 периодов.
Первые три периода называются малыми. В первом периоде только два элемента: водород Н и гелий Не. Второй и третий – содержат по восемь элементов. Второй период – это элементы от №3 (литий Li − щелочной металл) до №10 (неон Ne − инертный газ). Третий период – это элементы от №11 (натрий Na − щелочной металл) до №18 (аргон Ar − инертный газ).
Начиная с четвертого, периоды называются большими. В четвертом и пятом периодах находятся по 18 элементов. Для этих периодов характерно то, что более или менее полное повторение свойств наблюдаются через 18, а не через 8 элементов. Шестой период – это 32 элемента от щелочного металла цезия (Cs − №55) до инертного газа радона (Rn − №86). 14 элементов в этом периоде, следующие за лантаном (La − №57), очень сходны по своим свойствам, поэтому они называются лантаноидами. Поскольку различие в химических свойствах этих элементов очень мало, они вынесены из таблицы в отдельную строку. Седьмой период незакончен.
Вертикальные ряды в таблице называются группами. В периодической системе – 8 групп, что соответствует максимальному числу электронов во внешних оболочках. Каждая группа делится на главную и побочную подгруппы. Подгруппы включают в себя элементы с аналогичными электронными структурами и сходными химическими свойствами.
Главные подгруппы (подгруппы А) составляют элементы малых и больших периодов.
Побочные подгруппы (подгруппы В) – элементы только больших периодов. К побочным подгруппам принадлежат d- и f-элементы.
|
|
|


