 |
С повышением температуры растворимость твёрдых веществ увеличивается.
|
|
|
|
Билет 1.
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. В многоэлектронных атомах энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня, третий энергетический уровень – на три подуровня.Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей.
Принцип Паули: В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином).
Принцип наименьшей энергии: заполнение электронами АО происходит в порядке возрастания их энергии.
Правило Хунда: При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов.
Правило Клечковского: энергия атомной орбитали возрастает в соответствии с увеличением n +l главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у атомной орбитали с меньшим значением главного квантового числа.
|
|
|
Квантовые числа:
1) Главное квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Обозначается как n. Оно равно номеру периода элемента.
2) Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент р — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное).
3) Состояние электрона, обусловленное орбитальным магнитным моментом электрона (в результате его движения по орбите), характеризуется третьим квантовым числом — магнитным m1. Это квантовое число характеризует ориентацию орбитали в пространстве, выражая проекцию орбитального момента импульса на направление магнитного поля.
4) Для объяснения всех свойств атома в 1925 г. была выдвинута гипотеза о наличии у электрона так называемого спина. Спин — это квантовое свойство электрона, не имеющее классических аналогов. Спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = 1/2. Проекция спина на ось(магнитное спиновое число ms) может иметь лишь два значения: ms = 1/2 или ms = -1/2.
Как уже было сказано, на каждой из орбиталей могут находиться два электрона. Таким образом, возможное число s-электронов в данном энергетическом уровне равно 2 и т.д. Если в орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании.
|
|
|
Возбужденное состояние атома - энергетически нестабильное состояние, в которое атом переходит, получая энергию извне. В возбужденном состоянии атом может пребывать лишь короткое время. Возбужденный атом, отдавая энергию, возвращается в основное состояние.
Билет 2.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Сигма (σ)-, пи -связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании пи -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи.
|
|
|
Длина связи -расстояние между ядрами атомов.
Кратность связи -число электронных пар,связывающих атомы.
Энергия связи -разность между полной энергией связанного состояния системы тел или частиц и энергией состояния, в котором эти тела или частицы бесконечно удалены друг от друга и находятся в состоянии покоя
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Лишь немногие химические элементы (благородные газы) в обычных условиях находятся в состоянии одноатомного газа. Атомы остальных элементов, наоборот, в индивидуальном виде не существуют, так как могут взаимодействовать между собой или с атомами других элементов, образуя при этом более или менее сложные частицы. Среди частиц образуемых совокупностью атомов обычно выделяют молекулы, молекулярные ионы и свободные радикалы. Следовательно, существует причина, по которой атомы «связываются» друг с другом. Эта причина получила название «химическая связь»; она обусловлена тем, что между атомами действуют электростатические силы, т. е. силы взаимодействия электрических зарядов, носителями которых являются электроны и ядра атомов.
Билет 3.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
Концентрацию веществ в растворах можно выразить разными способами: Массовая доля растворённого вещества, молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора, Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
|
|
|
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд.
Растворение – сложный физико-химический процесс. Физическая его часть – это разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя. Химическая сторона процесса растворения – взаимодействие молекул растворителя с частицами растворенного вещества. В результате этого взаимодействия образуются сольваты – продукты переменного состава.
Гидратная вода иногда настолько прочно связана с растворенным веществом, что прн выделении последнего из раствора входит в состав его кристаллов. Такие кристаллические образования, содержащие в своем составе воду, называются кристаллогидратами. Вода, входящая в структуру кристаллов других веществ, называется кристаллизационной. Состав кристаллогидратов обычно выражают, указывая при формуле вещества число молекул кристаллизационной воды, приходящейся на одну его молекулу.
Растворимость твердых веществ в жидкостях в первую очередь определяется характером химических связей в их кристаллических решетках. Надо отметить, что молекулярные (или атомные) кристаллы, структурными единицами которых являются атомы или молекулы с ковалентным неполярным типом связи, практически не растворимы в воде(например, графит, алмаз, сера, кристаллический иод и др.)
Ингредиенты теплового эффекта:
Энергия кристаллической решетки оценивается количеством энергии, которое необходимо затратить для разрушения кристаллической решетки на составные части и удаления их друг от друга на бесконечно большое расстояние.
Энергия сольватации представляет собой выигрыш в энергии, который получается при перенесении моля исследуемых ионов из вакуума в данный растворитель.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
С повышением температуры растворимость твёрдых веществ увеличивается.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
|
|
|
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество.
Условие выпадения осадка только одно: произведение концентраций соответствующих ионов в степенях стехиометрических коэффициентов больше, чем произведение растворимости соли при данной температуре.
При растворении вещества в воде после образования насыщенного раствора устанавливается равновесие.Если добавить в раствор дополнительное количество ионов то равновесие сдвинется влево. В этом заключается эффект общего иона.
Направление реакций ионного обмена определяется следующим правилом: ионные реакции протекают в сторону образования осадков (труднорастворимых веществ), газов (легколетучих веществ), слабых электролитов (плохо диссоциирующих соединений), комплексных ионов.
Билет 4.
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
Для оценки скорости необходимо измеренение концентрации одного из веществ.
Наибольший интерес представляют реакции, протекающие в однородной (гомогенной) среде. Математически скорость химической гомогенной реакции можно представить с помощью формулы:

Для гетерогенной реакции, скорость реакции определяется числом молей веществ, вступивших в или образующихся в результате реакции в единицу времени на единице поверхности:

Для сложных реакций, состоящих из неск. стадий, механизм реакции-это совокупность стадий, в результате к-рых исходные в-ва превращаются в продукты. Для простой р-ции (элементарной р-ции, элементарной стадии), к-рая не может быть разложена на более простые хим. акты, выяснение механизма реакции означает идентифицирование физ. процессов, составляющих сущность хим. превращения.
Элементарная стадия (элементарная реакция) - единичный акт образования или разрыва химической связи при непосредственном взаимодействии частиц (молекул, ионов, радикалов).
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для элементарной химической реакции:

закон действующих масс может быть записан в виде кинетического уравнения вида:

где  — скорость химической реакции,
— скорость химической реакции,  — константа скорости реакции.
— константа скорости реакции.
Следствия:
1) замедление химической реакции по мере её прохождения
2) Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации.
В уравнении Менделеева-Клапейрона:
pV = nRT
перенесем V в правую часть,, а RT - в левую и учтем,
что n/V = c:
p/RT = c
Давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации p/RT.
3) Псевдопорядок реакции возникает в тех случаях, когда одним из реагентов является катализатор, концентрация которого не меняется во времени, так как он регенерируется так же быстро, как и расходуется, или когда реакцию проводят в среде, где поддерживается постоянная концентрация реагента.
4) В отсутствие диффузионных затруднений скорость гетерогенной реакции пропорциональна размерам реакционной зоны; так называемая удельная скорость реакции, рассчитанная на единицу поверхности (или объема) реакционной зоны, не изменяется во времени; для простых (одностадийных) реакций она может быть определена на основе действующих масс закона. Этот закон не выполняется, если диффузия веществ протекает медленнее, чем химическая реакция; в этом случае наблюдаемая скорость гетерогенные реакции описывается уравнениями диффузионной кинетики.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Суть теории переходного состояния:
1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
Энергия активации в химии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
Правило Вант-Гоффа:При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:

Здесь 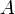 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул, 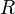 — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений зависит от температуры, но эта зависимость достаточно медленная:

Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Билет 5.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном).
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции:
ΔHреакции = ΣΔHf (продукты) — ΣΔHf (реагенты).
Равновесие.
В отличие от закона действующих масс в уравнении скорости 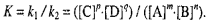
Показатели степени всегда равны стехеометрическим коэффициентам.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение концентрациями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции:
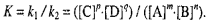





Проце́сс Хабе́ра (Габе́ра) — промышленный процесс (изобретен Фрицем Хабером и Карлом Бошем), в котором атмосферный азот «связывается» путем синтеза аммиака. Смесь азота и водорода пропускается через нагретый катализатор под давлением около 1000 атмосфер. При этом возрастает скорость экзотермической реакции N2+3H2 ↔ 2NH3. Важным свойством процесса Габера является его безотходность. Реакция образования аммиака из водорода и азота равновесная и экзотермическая, поэтому при высоких температурах (необходимых для достижения приемлемой скорости реакции) равновесие смешается в сторону азота и водорода, и выход аммиака за один проход катализатора в промышленных условиях не превышает 14-16%.
Билет 6.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов». Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная Менделеевым Периодическая система элементов.
В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева (атомный номер) является мерой электрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома, а номер вертикального ряда — квантовую структуру верхней оболочки, чему элементы этого ряда и обязаны сходством химических свойств.
Подгруппы, в которых расположены s- и p-элементы, называют ГЛАВНЫМИ, а подгруппы с d-элементами - ПОБОЧНЫМИ ПОДГРУППАМИ. Главные и побочные подгруппы иногда обозначают соответственно буквами "А" и "Б", или "А" и "В", или "а" и "б".
Лантано́иды (лантани́ды) — семейство из 14 химических элементов III группы 6-го периода периодической таблицы. Семейство состоит из церия, празеодима, неодима, прометия, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия, иттербия и лютеция. Лантан часто рассматривается вместе с этими элементами для удобства сравнения, хотя к лантаноидам он не относится.Все лантаниды вместе с лантаном, скандием и иттрием входят в состав группы редкоземельных элементов.
Актино́иды (актини́ды) — семейство, состоящее из 14 радиоактивных химических элементов III группы 7-го периода периодической системы с атомными номерами 90—103.
Данная группа состоит из тория, протактиния, урана, нептуния, плутония, америция, кюрия, берклия, калифорния, эйнштейния, фермия, менделевия, нобелия и лоуренсия. Актиний часто для удобства сравнения рассматривается вместе с этими элементами, однако к актиноидам он не относится. Термин «актиноиды» был предложен Виктором Гольдшмидтом в 1937 году.
Билет 7.
Реагенты Продукты Тип химической реакции
Состав
(простые/
сложные) число состав
(простые/
число сложные) схеманазвание
> 1 Любые 1 Сложное А + В + С АВС Соединение
1 Сложное > 1 Любые АВС А + В + С Разложение
2 Простое + сложное 2 Сложное + простое А + ВС АВ + С Замещение
2 Сложное + сложное 2 Сложное + сложное АВ + СD AD + BC Обмен
1 Простое 1 Простое A A Аллотропное превращение
1 Сложное 1 Сложное ABC ACB Изомеризация
|
|
|


