 |
По фазовому составу реагирующей системы
|
|
|
|
Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:
NaOH+ HCl→ NaCl+ H2O
Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
CO3+ 2HCl→ Cl2 + CO2 + H2O
Гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы, однако реакционная смесь является гетерогенной. Например, реакция образования хлорида аммония из газообразных хлороводорода и аммиака:
NH3+ HCl→ NH4Cl
Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах одной фазы, однако реакция протекает на поверхности раздела фаз. Примером таких реакций являются некоторые гетерогенно-каталитические реакции, например, реакция синтеза аммиака из водорода и азота:
N2+ 3H2→ 2 NH3(газ) (катализатор Pt)
По изменению степеней окисления реагентов
В данном случае различают
Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления.
|
|
|
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
NH4NO3 = N2O + 2H2O (до 250 °C)
Не окислительно-восстановительные реакции — соответственно, реакции, в которых не происходит изменения степеней окисления атомов, например, указанная выше реакция нейтрализации.
По тепловому эффекту реакции:
1)экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, указанное выше горение водорода
2)эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды.
Виды окислительно-восстановительных реакций:
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Влияние среды на характер протекания реакций:
Реакции окисления-восстановления могут протекать в различных средах: в кислой (избыток Н+-ионов), нейтральной (Н2O) и щелочной (избыток гидроксид-ионов OH-). В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Так, например, ион MnO-4 в кислой среде восстанавливается до Mn2+, в нейтральной — до MnO2, а в щелочной — до MnO2-4.
|
|
|
K2Cr2O7
Кислая среда (Н+) Cr+6 (K2Cr2O7)(раствор оранжевого цвета)
Щелочная среда (ОН-) Cr+6 (K2CrO4)(раствор желтого цвета)
Метод электронного баланса: В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основании известных свойств элементов.
Метод полуреакций, или электронно-ионный метод:
Как показывает само название, этот метод основан на составлении ионных уравнений из процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение.
Билет 8.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
По протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты — водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие кислотные свойства, так называемые апротонные кислоты.
По содержанию кислорода:
бескислородные (HCl, H2S);
кислородосодержащие (HNO3,H2SO4).
По основности — количество кислых атомов водорода
Одноосновные (HNO3);
Двухосновные (H2SeO4, двухосновные предельные карбоновые кислоты);
Трёхосновные (H3PO4, H3BO3).
Полиосновные (практически не встречаются).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По окислительной способности различают кислоты-окислители – HNO3 и концентрированная H2SO4, и кислоты-неокислители – все остальные.
|
|
|
Получение:
Кислотные оксиды(бинарные соединения)+H2O
Соль с другой кислотой
Неметаллы+HNO3
Химические свойства:
Взаимодействие с основными оксидами с образованием соли и воды:

Взаимодействие с амфотерными оксидами с образованием соли и воды:

Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):

Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
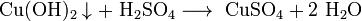
Взаимодействие с солями, если выпадает осадок или выделяется газ:

Сильные кислоты вытесняют более слабые из их солей:


(в данном случае образуется неустойчивая угольная кислота, которая сразу же распадается на воду и углекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты), если образующаяся соль растворима:
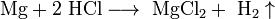
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
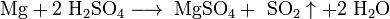
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):

Билет 9.
Реакции с простыми веществами
С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:

Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
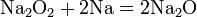
Со средними и малоактивными металлами реакция происходит при нагревании:

С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:

При нагревании:

С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:

С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
|
|
|

С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
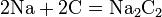
Взаимодействие кислот с металлами
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:

Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:

Очень разбавленная кислота реагирует с металлом по классической схеме:

При увеличении концентрации кислоты образуются различные продукты:

Реакции для азотной кислоты (HNO3)

При взаимодействии с активными металлами вариантов реакций ещё больше:

Электрохимический ряд активности (напряжения) металлов показывает их сравнительную активность в реакциях окисления-восстановления (слева направо восстановительная активность уменьшается
Металл, находящийся в ряду напряжений левее водорода, способен вытеснить водород из кислот или солей.
Ион лития, обладая значительно меньшим радиусом, чем ион цезия, более прочно связывает с собой молекулы гидратной воды. Поэтому в ряду напряжений литий стоит впереди цезия.
|
|
|


