 |
Гены, контролирующие развитие опухоли
|
|
|
|
Развитие злокачественных опухолей является многоэтапным генетически контролируемым процессом, представляющим собой микроэволюцию отдельных клеточных клонов в пределах опухоли. Прогрессия опухоли обусловливается возникновением мутаций в одном или нескольких генах, функционирующих кооперативно, и отбором мутантных клеточных клонов.
В ходе развития рака, гены, вовлеченные в этот процесс, меняют свой функциональный статус. По характеру изменения гены разделяют на протоонкогены, или доминантные онкогены; и гены-супрессоры опухоли.
Белковые продукты протоонкогенов являются компонентами сигнальной системы, контролирующей процесс пролиферации и дифференцировки клетки (семейство G-белков, интегрины). Для протоонкогенов канцерогенным событием является их активация, осуществляющаяся тремя путями:
1. первый путь - мутация в кодирующей или регуляторной области протоонкогена. Например, это замена нуклеотида в ДНК, ведущая к замене аминокислоты в белковой цепи и к изменению функции белка;
2. второй - амплификация протоонкогена (семейство myc генов, онкоген NMYC в случае ретинобластом и неройбластом достигает 200 копий на клетку);
3. третий - хромосомные перестройки (филадельфийская хромосома, обнаруживаемая при хроническом миелолейкозе, в 95% случаев возникает от транслокации фрагмента 9 хромосомы на 22, с образованием химерного гена BCR-ABL).
Есть и другие способы активации онкогена. После активации протоонкоген становится онкогеном. Результатом активации протоонкогена, как правило, становится усиление пролиферации. Онкоген доминирует над оставшейся нормальной копией протоонкогена. Число известных онкогенов непрерывно растет и уже насчитывает более 100. Для всех онкогенов канцерогенным событием является усиление их экспрессии.
|
|
|
Супрессоры опухоли
После открытия первых онкогенов появились сообщения о существовании генов, утрата или подавление активности которых также приводит к развитию опухолей, то есть белковые продукты этих генов необходимы для того, чтобы не дать клетке превратиться в раковую. Эти гены были названы антионкогенами или генами-супрессорами опухолей (ГСО).
В случае ГСО канцерогенное событие связано с потерей нормальной функции при возникновении точковых рецессивных мутаций или делеций, которые передаются по наследству. В геноме человека описано более 100 генов-супрессоров опухолей.
Гетерозиготы по мутантным аллелям генов-супрессоров, так называемые зародышевые мутанты, имеют повышенную наследственную предрасположенность к возникновению рака.
Следовательно, гетерозиготность по мутантным аллелям может быть использована для диагностики предрасположенности индивида к раковому заболеванию.
Супрессоры – это гены, участвующие в негативном контроле клеточного цикла (гены Rb, p53 и p21) и гены, поддерживающие стабильность генома (Rad51, BRCA1, BRCA2, ATM, MLH1, MSH2, PMS2). Для индукции канцерогенеза необходима инактивация обоих аллелей гена - супрессора, т.е. в данном случае нормальный аллель гена доминирует над мутантным.
Продукт гена Rb1 является негативным регулятором протоонкогенов, активация которых необходима для инициации пролиферации в нормальных клетках.
При связывании pRb с некоторыми трансформирующими белками ДНК-содержащих вирусов: T antigen (вируса SV40), Е1А (аденовируса), Е7 (вируса папилломы человека 16 и 18 типов), происходит активация промоторов генов клеточной пролиферации (c-myc, N-myc и др.), что приводит к возникновению опухоли (Hakem, Mak, 2001).
Таким образом, степень фосфорилирования pRb контролирует транскрипцию генов, ответственных за клеточную пролиферацию. Отсутствие данного белка или его инактивация приводят к трансформации клетки, что часто наблюдается при ретинобластоме, остеосаркоме и карциноме легких. Основные мутации гена Rb1 связаны с крупными делециями внутри гена и нонсенс-мутациями.
|
|
|
Ген Rbбыл первым открытым геном-супрессором опухолей. Этот ген кодирует белок ретинобластомы. Его функция заключается в негативном контроле клеточного цикла. В нормальных клетках ген экспрессируется в течение всего клеточного цикла. Активность Rb зависит от степени его фосфорилирования, которая контролируется циклинзависимыми киназами и фосфатазами. Полное фосфорилирование белка происходит при переходе клетки из стадии G1 в S. В гипофосфорилированном состоянии белок связывается со свободным фактором транскрипции E2F. В комплексе с Rbэтот фактор не способен активировать транскрипцию генов, ответственных за пролиферацию. Это приводит к задержке клетки в фазе G1 (рис. 3) (Hakem, Mak, 2001). Комплекс pRb с E2F связывается с деацетилазами семейства HDAC (HDAC1 и HDAC2).
Тройной комплекс садится на нуклеосомы и сохраняет "закрытую" форму хроматина в области промоторов генов клеточной пролиферации, и, таким образом, препятствует их транскрипции.
При фосфорилировании белка pRb комплекс распадается, и структура хроматина под действием ацетилаз становится "открытой" (Luo, Dean, 1999).
Такое фосфорилирование pRb осуществляется циклинзависимыми киназами. В начале G1 фазы киназы cdk4 и cdk6, связанные с циклином D, фосфорилируют С-концевой участок белка, что приводит к высвобождению деацетилазы.
На следующем этапе киназа cdk2, связанная с циклином E, продолжает фосфорилирование, что приводит к распаду комплекса pRb/E2F.
В результате мутации в регуляторном участке гена циклина D1 может происходить усиление его экспрессии.
Избыточное количество циклина D конкурентно связывается с pRb вместо E2F, и приводит к образованию опухоли, т.к. E2F получает возможность постоянно стимулировать клеточную пролиферацию.
Одним из ключевых генов, подавляющих развитие опухоли, служит ген Р53, продуктом которого является белок р53 (tumor suppressor protein). Его вклад в предотвращение трансформации нормальных клеток в раковые трудно переоценить. Частота инактивации гена Р53 в различных типах опухолей составляет более 50 %. Белок p53 контролирует такие жизненно важных процессы, как репарация, рекомбинация, клеточный цикл и апоптоз. Его участие в этих процессах может быть как прямое (в репарации и рекомбинации), так и через активацию других генов (регуляция клеточного цикла и апоптоза) (Рис.21.4.1).
|
|
|
Ген Р53 необычен тем, что 80 % всех мутаций, возникающих в нем, относятся к аминокислотным заменам (частота миссенс-мутаций в других генах-супрессорах колеблется в районе 10 %). Белок р53 небольшой (394 аминокислоты), и высоко-консервативный, поэтому почти все миссенс-мутации приводят к нарушению его функций. Унаследованные мутации в
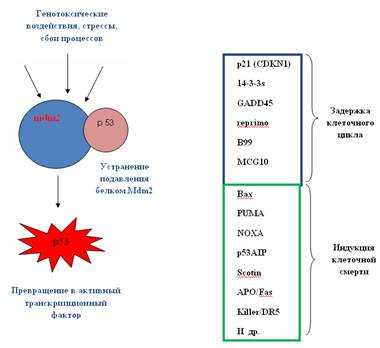
Рис. 21.4.1. Участие p53 – индуцируемого белка в негативной регуляции пролиферации клеток.
гене Р53 приводят к развитию в раннем возрасте синдрома Ли-Фраумени, характеризующегося повышенной частотой развития в организме всех типов опухолей
В 1992 году Vogelstein и Kinzler постулировали необходимость наличия тетрамерной формы белка р53 для нормального функцинирования клетки. Они предложили пять возможных механизмов инактивации Р53:
1. утрата в результате делеции одной или обеих копий гена, приводящей к снижению экспрессии ингибиторов клеточного роста;
2. укорочение белка (вследствие нонсенс-мутаций, сдвига рамки считывания и мутаций, нарушающих сплайсинг), препятствующее олигомеризации р53 (т.к. олигомеризационный домен находится на С-конце);
3. миссенс-мутации, оказывающие доминантно-негативный эффект на функции белка;
4. деградация р53, вызванная взаимодействием с онкобелоком Е6 вируса папилломы человека;
5. деградация р53, в результате сверхэкспрессии его антагониста гена MDM2.
В некоторых случаях опухолевые клетки могут вести себя как дефектные по гену Р53, но при этом иметь две нормальные копии этого гена. Такой же эффект, как и мутации в гене р53, может производить сверхэкпрессия гена MDM2. Кодируемый этим геном белок, связывается с белком р53, вызывая его убиквитинирование и последующую деградацию в протеосомах. Клетки со сверхэкспрессией гена MDM2 имеют недостаток белка р53, и, следовательно, все р53-зависимые ответы на стресс ослаблены или полностью подавлены.
|
|
|
BRCA1 является центральным компонентом белкового комплекса BASC. Этот комплекс включает более десятка белков. BRCA1 вместе с BRCA2 представляют собой ядро комплекса, на поверхности которого располагаются все остальные белки, постоянно или временно входящие в его состав (Рис.21.4.2).
При возникновении двунитевых разрывов ДНК белок BRCA1 фосфорилируется стрессовой киназой ATM и весь комплекс BASC перемещается в область повреждения. Двунитевые разрывы репарируются с помощью гомологичной рекомбинации. В этот процесс непосредственно вовлечены белки комплекса: MRE11, NBS1, RAD50 и RAD51 (белок

Рис 21.4.2. Отдельные комплексы, образуемые BRCA1 и BRCA2, вовлекаются в разнообразные клеточные процессы, такие как передача сигналов, разрушение белка, а также оказывают прямое и косвенное воздействие на механизмы гомологичной рекомбинации и репарацию ДНК. Нарушения этих процессов могут привести к неэффективной репарации повреждений ДНК, нестабильности генома и образованию опухоли (West, 2002).
гомологичной рекомбинации). В отсутствии повреждений ДНК белок BRCA2 связывается с RAD51 и подавляет его активность (Рис.21.4.3).

Рис. 21.4.3. Взаимодействия BRCA1 и BRCA2 с другими белками, или белковыми комплексами, установленные при помощи двойной гибридизации на подложке, анализом коиммунопреципитации и совместного фракционирования. Как правило, белок-белковые взаимодействия BRCA1 отличаются от белок-белковых взаимодействий BRCA2 (Liu, West, 2002).
Природа белковых продуктов онкогенов и ГСО чрезвычайно разнообразна.
Активации одного онкогена или, наоборот, потери функции одного ГСО недостаточно для превращения нормальной клетки в опухолевую. В среднем число таких мутационных событий составляет 10. При этом условии нормальная клетка становится раковой. У мышей, на которых ведется большинство экспериментов по индукции опухолей, этот барьер снижен - там необходимо 3-5 мутационных событий (Рис. 21.4.4).

Рис. 21.4.4. Кинетика развития опухолей у самок мышей, трансформированных одним или двумя онкогенными трансгенами, иллюстрирует кооперативную природу индукции рака множественными мутациями (Sinn et al., 1987).
Так как онкогенов и ГСО чрезвычайно много, набор мутаций в различных опухолях человека весьма разнообразен.
В одних опухолях активированы или подавлены одни гены, в других – другие, что и определяет ее свойства. Кроме того, опухоль часто бывает гетерогенна, то есть в ней присутствуют клетки с разным набором генетических изменений.
|
|
|
Изучение генов-супрессоров помогает понять причины возникновения рака и искать новые методы борьбы с ним. В настоящее время разработка методов клинического восстановления нормальной функции поврежденных генов-супрессоров роста опухолей - одно из наиболее перспективных направлений биологии рака.
Интенсивно изучается в последнее время генетический контроль образования ангиогенеза и экспрессии матриксных металлополимераз – основы образования метастазов.
|
|
|


