 |
I. Галогенопроизводные винильного типа.
|
|
|
|
Получение
1) Присоединение одной молекулы ННal к ацетиленовым углеводородам.
СН  СН + HCl
СН + HCl  СН2=СНCl
СН2=СНCl
хлористый винил
2) Пиролиз полигалогенопроизводных
СН2Cl-СН2Cl  HCl + СН2=СН-Cl
HCl + СН2=СН-Cl
3) Действие недостатка спиртового раствора КОН на полигалогенопроизводные
Cl Cl
СНCl-СНCl 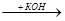 СНCl=CCl2
СНCl=CCl2
-HCl
Фреоны. Фреоны (хладоны) — техническое название группы насыщенных алифатических фторсодержащих углеводородов, применяемых в качестве хладагентов, пропеллентов, вспенивателей, растворителей. Кроме атомов фтора фреоны могут содержать атомы хлора или брома. Фреоны очень инертны в химическом отношении, поэтому они не горят на воздухе, невзрывоопасны даже при контакте с открытым пламенем. Однако при нагревании фреонов свыше 250 °C образуются весьма ядовитые продукты, например фосген COCl2, который в годы первой мировой войны использовался как боевое отравляющее вещество. Считается, что причиной уменьшения озона в стратосфере и образование озоновых дыр является производство и применение хлор- и бромсодержащих фреонов.[3] Попадая после использования в атмосферу, они разлагаются под воздействием ультрафиолетового излучения Солнца. Высвободившиеся компоненты активно взаимодействуют с озоном в так называемом галогеновом цикле распада атмосферного озона.Подписание и ратификация странами ООН Монреальского протокола привело к уменьшению производства озоноразрушающих фреонов и способствует восстановлению озонового
Используется в качестве рабочего вещества — хладагента в холодильных установках.
Как выталкивающая основа в газовых баллончиках.
Применяется в парфюмерии и медицине для создания аэрозолей.
Применяется в пожаротушении на опасных объектах (например, электростанции, корабли и т. д.)
|
|
|
Как вспенивающий реагент при производстве полиуретановой продукции.
В качестве сырья для промышленного производства фторолефино]:
тетрафторэтилена 2CF2HCl → CF2 = CF2 + 2HCl;
трифторхлорэтилена CF2ClCFCl2 + Zn → CF2 = CFCl + ZnCl2;
винилиденфторида CF2ClCH3 → CF2 = CH2 + HClслоя Земли.
Самый стойкий, самый прочный. Тефлон
Ближайшие родственники полиэтилена, сходные с ним по строению, подчас сильно отличаются от него по свойствам и приятно удивляют учёных новыми ценными качествами.
Если заменить все атомы водорода в молекуле этилена на атомы фтора, то этилен превратится в тетрафторэтилен, полимеризацией которого химики- технологи получили первую фторсодержашую пластмассу (фторопласт). Политетрафторэтилен, названный впоследствии тефлоном, по многим механическим, физическим, химическим свойствам, как оказалось, превосходит не только полиэтилен, но и все остальные известные полимеры. Этот материал безразличен к действию любых растворителей и имеет необычно высокую температуру размягчения, равную 327 °С. А разложение тефлона начинается при рекордной для полимеров температуре — 425 °С! Тефлон обладает непревзойдённой химической стойкостью: он совершенно не горит, на него не действуют концентрированные кислоты и щёлочи, даже таким химическим агрессорам, как галогены, царская водка и фтороводородная кислота, тефлон «не по зубам». Поливинилхлорид (ПВХ, полихлорвинил, винил, вестолит, хосталит, виннол, корвик, сикрон, джеон, ниппеон, сумилит, луковил, хелвик, норвик и др.) — бесцветная, прозрачная пластмасса, термопластичный полимер винилхлорида. Отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям. Не горит на воздухе, но обладает малой морозостойкостью (−15 °C). Нагревостойкость: +65 °C. Применяется для электроизоляции проводов и кабелей, производства листов, труб (преимущественно хлорированный поливинилхлорид), пленок, пленок для натяжных потолков, искусственных кож, поливинилхлоридного волокна, пенополивинилхлорида, линолеума, обувных пластикатов, мебельной кромки и т. д. Также применяется для производства грампластинок (т. н. виниловых), профилей для изготовления окон и дверей
|
|
|

ДИЕНОВЫЕ УГЛЕВОДОРОДЫ
Диеновыми углеводородами называются углеводороды открытого строения с двумя двойными связями. Общая формула СnH2n-2. В зависимости от расположения двойных связей они подразделяются на 3 вида:
1. Углеводороды с кумулированными связями (две двойные связи рядом).
| CH2=C=CH2 | аллен | 1, 2-пропадиен |
| CH3-CH=C=CH2 | метилаллен | 1, 2-бутадиен |
Эти соединения мало устойчивы и не имеют большого распространения.
2. Углеводороды с изолированными связями (две двойные связи, разделенные более чем одной простой), например:
| CH2=CH-CH2-CH=CH2 | 1, 4-пентадиен |
3. Углеводороды с сопряженными связями (две двойные связи, расположенные через одну простую):
| CH2=CH-CH=CH2 | дивинил | 1,3-пентадиен |
| CH2=C-CH=CH2 CH3 | изопрен | 2-метил-1,3-бутадиен |
Способы получения
Применяются общие методы введения двойной связи. Рассмотрим эти методы на примере получения наиболее важных диенов с использованием доступного сырья.
1. Дегидрирование предельных углеводородов или алкенов (метод Бызова), например:
СH3-CH2-CH2-CH3  H2+CH2=CH-CH2-CH3
H2+CH2=CH-CH2-CH3  5500C H2+CH2=CH-CH=CH2
5500C H2+CH2=CH-CH=CH2
2. Получение бутадиена из этилового спирта (метод Лебедева):
CH2OH-CH3 + CH3-CH2OH  2H2O+H2+CH2=CH-CH=CH2
2H2O+H2+CH2=CH-CH=CH2
3. дегидрирование галогеналканов
СН2=СН-СН2-CI  CН2=C=CН2
CН2=C=CН2
4. дегтдротация спиртов
СН2=СН-СН2-ОН  СН2=С=СН2+Н2О
СН2=С=СН2+Н2О
5. дегалогенирование дигалогеналканов
СН2=СCI-CH2CI+Zn  CН2=С=СН2
CН2=С=СН2
6. обработка спиртовым раствором дигалогеналканов
CCI-C-C-CCI+NaOH  C=C-C=C
C=C-C=C
7. дегидротация спиртов
СОН-С-С-СОН+H2SO4  C=C-C=C+H2O
C=C-C=C+H2O
8. С=С-С  С+Н2
С+Н2  С=С-С=С
С=С-С=С
Физические свойства
1. Диеновые углеводороды обладают более высокой температурой кипения, чем олефины:
1,3-бутадиен - +4,5оС; 1-бутен – 6,3оС.
2. Плотность их также выше, чем у олефинов, т.к. растет % содержания С: у пентена – 0,64 у пентадиена – 0,70.
3. Также выше показатель преломления (1,4 – 1,47 вместо 1,36 – 1,38 у этиленовых) – экзальтация МR.
2. Реакции окисления
Диены легко окисляются за счет активных двойных связей. Реакции идут так же, как у олефинов, за счет разрыва двойной связи.
|
|
|
1. Под действием озона:
СH2=CH-CH=CH2+2O3  CО2 +H2О +CH3-CО-CООН
CО2 +H2О +CH3-CО-CООН
2. Окисление молекулярным кислородом протекает:
а) с образованием перекисных олигомеров
CH2=CH-CH=CH2+ O2  (-CH(CH CH2)-CH2-O-O-)n
(-CH(CH CH2)-CH2-O-O-)n  (-CH2-CH=CH-CH2-O-O-)n
(-CH2-CH=CH-CH2-O-O-)n
б) могут образовываться циклоперекисные продукты, здесь молекула кислорода работает как диенофил.

|
+ O  O
O
| 
|
3. Реакции полимеризации
Полимеризация диеновых углеводородов происходит в основном за счет 1,4-присоединения, хотя известны и 1,2-полимеры. Механизм реакций может быть ионным (металлические, металлорганические катализаторы) или свободно-радикальлным (в присутствии перекисного индикатора)
СH2=CH-CH=CH2  (-CH2-CH=CH-CH2-)n 1 тип
(-CH2-CH=CH-CH2-)n 1 тип
СH2=CH-CH=CH2  (-CH2-CH-)n
(-CH2-CH-)n
2 тип
CH2=CH2  (-(CH2-CH=CH-CH2)x-(CH2-CH))n
(-(CH2-CH=CH-CH2)x-(CH2-CH))n
3 тип
III тип полимеризации наблюдается при использовании щелочных металлов в качестве катализатора. I и II тип полимеризации наблюдается при использовании катализатора Циглера.
Пространственная структура полимеров, полученная в присутствии катализатора Циглера, отличается регулярностью повторения однотипных звеньев, такие полимеры называются стереорегулярными. При этом наблюдается несколько видов стереоизомерии. 1,4-стереорегулярные полимеры могут иметь цис- или транс-строение.
H H H CH2-
C=C C=C
-CH2 CH2- -CH2 H n
цис-
ОРГАНИЧЕСКАЯ ХИМИЯ Введение
Предмет органической химии. Этапы развития. Место органической химии в системе наук. Роль органической химии в народном хозяйстве. Основные источники органических соединений. Органический, промышленный, микробиологический синтезы. Проблемы экологии.
РАЗДЕЛ 1.1 ХИМИЧЕСКАЯ СВЯЗЬ И ХИМИЧЕСКИЕ РЕАКЦИИ.
Квантово-химическое описание атомов элементов II периода, квантовые числа. Формулы Льюиса. Правила октетов. Ковалентная связь, способы образования и разрыва. Электроотрицательность. Атомные и молекулярные орбитали. Гибридизация и гибридные орбитали. σ- и π- связи. Механизмы образования химической связи. Характеристика химической связи: длина, энергия, полярность. Индукционные и мезомерные эффекты
|
|
|
1.2 ХИМИЧЕСКАЯ РЕАКЦИЯ.
Классификация органических реакций: реакции обмена, отщепления, присоединения, перегруппировки, гомолитическая реакция, гетероциклическая. Классификация ионных реакций и реагентов: электрофильные, нуклеофильные. Реакции элиминации. Перегруппировки.. Ориентация и причины явлений ориентации. Гиперконьюгация.
РАЗДЕЛ 2. ОСНОВНЫЕ ПОНЯТИЯ В ОРГАНИЧЕСКОЙ ХИМИИ.
Классификация органических соединений. Изомерия. Углеродные цепи, углеводородные радикалы, функциональные группы, гомологические ряды. Классификация органических соединений по углеводородному радикалу и функциональным группам. Типы изомерии. Структурная изомерия. Пространственная изомерия: энантиомеры и диастереомеры. Проекционные формулы Фишера, Ньюмена. Рацемат, рацемическая смесь.
Методы выделения, очистки и идентификации органических соединений. Хроматография, перегонка, экстракция. Спектральные методы анализа.
РАЗДЕЛ 3. УГЛЕВОДОРОДЫ.
3.1 НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ (АЛКАНЫ)
Гомологический ряд. Общая формула. Изомерия. Первичный, вторичный и третичный атомы углерода. Понятие об алкилах, их названия. Номенклатура. Способы получения: промышленные и лабораторные. Строение, геометрия, конформации. Физические особенности. Химические свойства алканов. Строение и стабильность радикалов. Понятие о цепных реакциях. Реакции галогенирования, сульфохлорирования, сульфирования, нитрования. Виды крекинга алканов. Синтез алкенов, алкинов, галогенпроизводных, спиртов, альдегидов, карбоновых кислот. Экологические проблемы получения и использования углеводородов, галогенпроизводных и моторного топлива.
3.2 ЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ (ЦИКЛОАЛКАНЫ).
Классификация по размеру цикла, количества циклов, насыщенности. Геометрия цикла, конформации. Устойчивость циклов. Методы получения циклоалканов. Химические особенности циклоалканов. Реакции присоединения, замещения, расширения и сужения циклов. Примеры бицикличных углеводородов. Терпеновые углеводороды и стероиды.
3.3 НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ.
Общая формула алкенов, алкадиенов, алкинов. Классификация диенов. Структурная номенклатура и пространственная изомерия. Номенклатура ненасыщенных углеводородов. Методы получения. Общие методы получения кратной связи- дегидрирование алканов, дегидратация спиртов, дигидрогалогенирование галогеналканов, термический крекинг углеводородов. Получение алкенов реакциями конденсации, гидрированием алкинов, расщеплением по Гофману и т.д. Методы получения алкинов: карбидный способ, алкилирование ацетиленидов и т.д.. Синтез дивинила, изопрена.
|
|
|
Электронное строение, особенности π-связи: длина, энергия, полярность. Химические особенности. Общая характеристика реакционной способности ненасыщенных углеводородов. Реакция гидрирования. Механизм, стабильность карбкатионов. Правило Марковникова. Эффект Хораша. Окисление алкенов: KMnO4, кислородом, озоном.Примеры реакций нуклеофильного присоединения к алкенам. Олигомеризация и полимеризация алкенов и диенов. Полиэтилен, полипропилен, полистирол. Полимеризация 1,3-диенов. Сополимеризация. Натуральный и синтетический каучук. Реакции нуклеофильного присоединения к алкинам: воды, спиртов, карбоновых кислот. Ацетилениды, их получение, особенности и применение. Реакции олигомеризации и полимеризации алкинов. Конденсация Фаворского. Диеновый синтез. Примеры цикличных диенов: циклопентадиен, фульвены и т.д.
3.4 АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ).
Классификация, изомерия, номенклатура. Особенности электронной структуры. Правило ароматичности Хюккеля, современная формулировка. Ароматические, неароматические и антиароматические углеводороды и ионы. Квантово-механическое описание бензола. Физические особенности ароматических углеводородов. Методы промышленного и лабораторного синтеза: ароматизация нефти, коксование угля, из каменноугольной смолы, циклоолигомеризация, дегидроциклизация, конденсация, декарбоксилирование, Вюрца-Фиттига, Фриделя-Крафтса. Химические особенности аренов. Реакции гидрирования, галогенирования, окисления, нитрования, сульфирования, алкилирования, ацилирования. Классификация заместителей по ориентационным способностям и по влиянию на скорость реакции. Ориентация в дизамещенных производных бензола. Реакции гомологов бензола по боковой цепи: галогенирование, нитрование, окисление. Применение бензола его гомологов. Многоядерные ароматические углеводороды, номенклатура, изомерия.. Физиологическое воздействие ароматических углеводородов на растения, животных и человека.. Способы борьбы с загрязнением окружающей среды ароматическими соединениями.
РАЗДЕЛ 4. ГАЛОГЕНПРОИЗВОДНЫЕ УГЛЕВОДОРОДЫ.
Классификация, изомерия, номенклатура. Способы получения галогенпроизводных: галогенирование углеводородов, присоединение галогенводородов к ненасыщенным углеводородов, из спиртов. Физические особенности, физические параметры связи C-Hal. Химические особенности.. Правило Зайцева. Конкуренция реакций замещения и элиминирования.. Получение аренов. Нуклеофильное замещение галогена в арилгалогенидах. Реакции галогенпроизводных с металлами. Реактивы Гриньяра. Использование в синтезах. Основные представители галогенпроизводных. Фреоны. Полимеры: поливинилхлорид, тефлон, хлоропрен. Загрязнение окружающей среды галогенпроизводными. Влияние на озоновый слой.
РАЗДЕЛ 6. КИСЛОРОДСОДЕРЖАЩИЕ УГЛЕВОДОРОДЫ.
6.1. СПИРТЫ И ФЕНОЛЫ.
Классификация, изомерия и номенклатура. Способы получения. Общие способы введения гидроксильной группы: гидролиз галогенпроизводных углеводородов, реакции азотистой кислоты с первичными аминами. Способы получения спиртов- гидратация алкенов, восстановление альдегидов и кетонов, гидролиз эфиров; по Гриньяру. Способы получения фенолов- кумольный метод, из сульфокислот, через соли диазония, выделение из продуктов коксования угля. Физические особенности, водородная связь. Физические параметры группы С-О-Н. Общая характеристика реакционной способности спиртов и фенолов. Спирты и фенолы как кислоты и основания, их амфотерность. Особенности реакций нуклеофильного замещения гидроксогруппы спиртов. Сравнительные особенности спиртов и фенолов, алкоголятов и фенолятов. Реакции межмолекулярной и внутримолекулярной дегидратации спиртов. Реакции окисления спиртов, условия. Дегидрирование спиртов. Основные представители спиртов. Многоатомные спирты: этиленгликоль, глицерин. Производные многоатомных спиртов: нитрат глицерина. Химические особенности, окисление йодной кислотой, получение хелатов. Влияние гидроксильной группы фенолов на реакционную способность ароматического цикла. Особенности и условия бромирования, нитрования, сульфирования. Алкилирование и ацилирование фенолов. Перегруппировки. Специфические реакции фенолов. Загрязнение окружающей среды фенолами, влияние на флору и фауну. Основные представители фенолов. Многоатомные фенолы: пирокатехин, резорцин, гидрохинон, пирогаллол, флороглюцин.
6.2. ОКСОСОЕДИНЕНИЯ.
АЛЬДЕГИДЫ. КЕТОНЫ. ХИНОНЫ. Классификация, номенклатура и изомерия. Общие способы получения для алифатического и ароматического рядов- окисление спиртов и углеводородов, гидролиз геминальных дигалогенидов, декарбоксилирование кислот и их солей, восстановление хлорангидридов кислот. Специфические методы получения алифатических альдегидов и кетонов- оксосинтез, гидратация алкинов; получение ароматических альдегидов и кетонов по Фриделю-Крафтсу и др. Физические особенности. Электронное строение и геометрические параметры карбонильной группы. Химические особенности. Реакции получения оксимов, гидразинов, иминов, оксинитрилов, полуацеталей, ацеталей. Реакции конденсации карбонильных соединений- альдольная, кротоновая. Формальдегидные смолы. Реакции окисления и восстановления. Реакция «серебряного зеркала» и реактива Фелинга с альдегидами. Окисление кетонов. Восстановление карбонильной группы. Реакции в ароматическом кольце при наличии карбонильной группировки: нитрования, галогенирование, сульфирование. Основные представители альдегидов и кетонов. Ненасыщенные альдегиды и кетоны, общая характеристика реакционной способности.
КАРБОНОВЫЕ КИСЛОТЫ. Классификация, номенклатура и изомерия карбоновых кислот. Способы получения. Физические особенности и влияние на них водородной связи. Электронная структура карбоксильной группы, энергия стабилизации. Общая характеристика реакционной способности, химические свойства. Ненасыщенные, дикарбоновые кислоты. Номенклатура, строение, методы получения. Многоосновные карбоновые кислоты. Основные представители ненасыщенных, дикарбоновых и поликарбоновых кислот. Ароматические моно- и поликарбоновые кислоты. Способы получения и химические особенности. Использование в синтезе и производстве
.
|
|
|


