 |
Покажите, как изменяются давление и температура потока реального газа при дросселировании.
|
|
|
|
Д р о с с е л и р о в а н и е м называют процесс понижения давления в газовом потоке при преодолении местного сопротивления в канале.
При дросселировании газа или пара протекает необратимый процесс снижения давления без совершения внешней работы. Если в канале имеется местное сопротивление в виде резкого сужения вида перегородки с отверстием, задвижки, клапана и т.п., то газовый поток перестраивает свою геометрическую форму, как до сужения, так и после него. Перестройка формы потока и перетекание через само сужение связано с образованием вихревых движений газа. Часть кинетической энергии потока идет на образование вихрей, часть – на преодоление сопротивления трения. Затраченная на это энергия необратимо превращается в теплоту, которая воспринимается газом. Поэтому давление после местного сопротивления не восстанавливается до первоначального. Изменение давления, скорости и температуры по длине канала приведено на рисунке. Скорость газа при протекании его через сужение возрастает, что вызывает снижение давления и температуры. После сужения скорость понижается, но давление, вследствие указанных причин, не восстанавливается до первоначального.
Степень снижения давления газа при дросселировании зависит от природы газа и его состояния, относительной величины сужения, скорости газа. Обозначим степень снижения давления через  ; тогда ее величина будет равна:
; тогда ее величина будет равна:
 ,
,
где ∆р – величина снижения давления;
р – давление на входе в сужение.
В энергетических установках дросселирование нежелательно, т.к. при падении давления снижаются энергетические возможности газа. Но иногда дросселирование является необходимым и создается искусственно, например, в редукторах, регуляторах и т.п.
|
|
|

Изменение давления и температуры при дросселировании
При термодинамическом анализе особенностей процесса дросселирования целесообразно использовать общее уравнение энергии:

В канале можно обеспечить с1 = с2, тогда i1 =i2. Из чего следует, что энтальпия газа в процессе дросселирования остается постоянной.
Этот вывод справедлив как для идеальных, так и для реальных газов. При дросселирования идеального газа Т1 = Т2, поскольку i1 = i2. Это значит, что для идеального газа температура после дросселирования равна температуре на входе в дроссель.
Для реального газа изменение температуры при его дросселировании в отличие от идеального газа имеет своеобразный характер. Как показывают опыты, температура реального газа в результате дросселирования повышается, понижается или не изменяется. Это свойство впервые обнаружили ученые Д. Джоуль и У. Томсон, поэтому оно носит название э ф ф е к т а Д ж о у л я-Т о м с о н а.
Используя дифференциальные уравнения, связывающие i, s, ρ и T, можно получить для газа, подчиняющегося уравнению Ван-дер-Ваальса, следующую зависимость:

Отношение бесконечно малого изменения температуры к бесконечно малому изменению давления при дросселировании называется д р о с с е л ь - э ф ф е к т о м и обозначается
α = 
Так как при дросселировании dp < 0, а cp – величина положительная, то знак α будет зависеть от знака числителя выражения.
При этом возможны три случая:
а)  < 0 (при T <
< 0 (при T <  ), тогда α > 0, т.е. dT < 0;
), тогда α > 0, т.е. dT < 0;
б)  > 0 (при T >
> 0 (при T >  ), тогда α < 0, т.е. dT > 0;
), тогда α < 0, т.е. dT > 0;
в)  = 0 (при T =
= 0 (при T =  ), тогда α = 0, т.е. dT = 0.
), тогда α = 0, т.е. dT = 0.
Изменение знака дроссель - эффекта α называется и н в е р с и е й,
а температура, при которой dT = 0, называется т е м п е р а т у о й и н в е р с и и и обозначается Tинв.
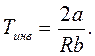
|
|
|
|
Каждый конкретный газ имеет индивидуальную температуру инверсии. Так, например, для воздуха Тинв = 650 К; для водорода Тинв = 204 К; для водяного пара Тинв= 682 К.
Для установления температуры реального газа после дросселя необходимо сравнить Tвх с Tинв. Если температура газа на входе в дроссель равна его температуре инверсии, то после дросселя она восстановится до прежнего значения. При Tвх< Tинв температура газа после дросселя уменьшится, а при Tвх> Tинв - она возрастет.
Задача
1.14. В баллоне емкостью 40 л содержится азот при давлении р1= 8 МПа и температуре t1 = – 25 0С. Определить количество теплоты, которое следует подвести к азоту, чтобы повысить его температуру до t2 = 18 0C. Каково будет конечное давление азота в баллоне?
Решение:
Конечное давление азота в баллоне:
P2 = P1*T2/T1 = 8*(18+273)/(273-25) = 9,4 МПа.
Массу азота в баллоне определяем из уравнения состояния:
P1*V = m*R*T1 → m = P1*V/(R*T1),
R = 297Дж/(кгК) – газовая постоянная для азота,
m = 8*106*40*10-3/(297*(273 – 25)) = 4,34 кг.
Количество теплоты, подведённое к азоту:
Q = m*Cvm*(t2 – t1) = 4,34*0,744*(18 – (-25)) = 138,845 кДж,
где Cvm = 0,744кДж/(кгК) – удельная массовая теплоёмкость азота при постоянном объёме.
Задание № 2
|
|
|


