 |
Расчет тепловых эф-тов х р
|
|
|
|
Любая химическая реакция, как известно, в общем случае сводится к разрушению определенного числа старых химических связей между атомами в молекуле и образованию новых связей: 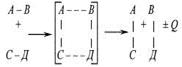 если энергия, выделяющаяся при образовании новых связей, больше энергии, затрачиваемой на разрушение связей в исходных молекулах, реакция происходит с выделением теплоты (экзотермический процесс). В том же случае, когда энергия, выделяемая при образовании новых связей, меньше энергии разрыва старых связей, реакция сопровождается поглощением тепла (эндотермический процесс). Это связано с тем, что при хим превращ изм-ся внутр энергия реагир-х мол-л.Изм-е внутр-й энергии dU в проц хим превращ происходит согласно 1 з-ну термодин за счет выделения или поглощ тепла и соверш работы dU=∆Q-A. dU явл ф-ей состояния и не зависит от пути х.р., а зависит от нач и конеч сост. ∆Q не явл ф-ей сост и зависит от пути хим проц.
если энергия, выделяющаяся при образовании новых связей, больше энергии, затрачиваемой на разрушение связей в исходных молекулах, реакция происходит с выделением теплоты (экзотермический процесс). В том же случае, когда энергия, выделяемая при образовании новых связей, меньше энергии разрыва старых связей, реакция сопровождается поглощением тепла (эндотермический процесс). Это связано с тем, что при хим превращ изм-ся внутр энергия реагир-х мол-л.Изм-е внутр-й энергии dU в проц хим превращ происходит согласно 1 з-ну термодин за счет выделения или поглощ тепла и соверш работы dU=∆Q-A. dU явл ф-ей состояния и не зависит от пути х.р., а зависит от нач и конеч сост. ∆Q не явл ф-ей сост и зависит от пути хим проц.
1.Изохорный процесс. Когда А=0 т.е.при хим превращ отсутствует изм-е объемар.м. то из ур-я Q=U2-U1=∆U т.е. теплота х.р. равна изм-ю внутр энергии х.р.
2.Изобарно-изотерм проц. Работа связана с изм-ем рабочей массы А=pdV,u+PV=H-энтальпия, Q=H2-H1=∆H.
Замечание:1)принято что Q=∆U и Q=∆H исли имеют полож знак то р-я протек с поглощ тепла; если отрец то с выделением тепла;2)в технич лит-ре теплоту х.р. выраж в термохимич ур-ем кот от термодин-го отличается знаком;3)М/у энталпией и внутр энергией имеется связь ∆H=∆U+PdV, ∆H=∆U+∆nRT.
Тепло, которое поглощается или выделяется в химическом процессе, называется тепловым эффектом химической реакции. Расчет тепловых эффектов химических реакций, протекающих в изобарно-изотермических условиях, проводят, опираясь на закон Гесса. Из закона Гесса и его следствий, в частности, вытекает:
|
|
|
1. Теплота химической реакции равна сумме теплот образования конечных продуктов реакции за вычетом суммы теплот образования исходных веществ: 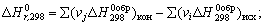 2. Теплота химической реакции равна сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных прод
2. Теплота химической реакции равна сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных прод  , где
, где 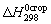 – теплота сгорания химического вещества до СО2 и Н2О;
– теплота сгорания химического вещества до СО2 и Н2О; 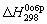 – теплота образования химического вещества из элементов, его составляющих;
– теплота образования химического вещества из элементов, его составляющих; 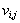 – стехиометрические коэффициенты в уравнении реакции.
– стехиометрические коэффициенты в уравнении реакции.
Закон Гесса позволяет легко рассчитывать тепловой эффект практически любой химической реакции при наличии в справочной литературе данных по теплотам сгорания или образования веществ, участвующих в реакции. Если такие данные отсутствуют, то приходится прибегать к эмпирическим методам расчета теплот сгорания и образования химических веществ. Рассм некоторые из таких методов
. Расчет 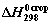 по Коновалову Для расчета стандартных теплот сгорания органических соединений в газообразном состоянии при 25 ºС Коноваловым было предложено уравнение:
по Коновалову Для расчета стандартных теплот сгорания органических соединений в газообразном состоянии при 25 ºС Коноваловым было предложено уравнение: 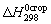 = –(48,8 m + 10,6 n + ∆), ккал/моль, где
= –(48,8 m + 10,6 n + ∆), ккал/моль, где 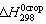 – теплота сгорания органического соединения до СО2 и Н2О; 48,8 – коэффициент, выражающий теплоту полного сгорания угля в расчете на 1 грамм-атом кислорода; 10,6 – коэффициент, учитывающий теплоту конденсации водяных паров, образующихся при сгорании органического вещества; m – число атомов кислорода, необходимое для полного сгорания органического вещества; n – число молей воды, образующихся при сгорании органического вещества; ∆ – поправочная величина. Для всех предельных органических соединений ∆ = 0; для непредельных ∆ > 0. Значение постоянно для всех членов данного гомологического ряда и растет с повышением непредельности соединения (∆С=С = 21 ккал/моль, ∆С≡С = 51 ккал/моль)
– теплота сгорания органического соединения до СО2 и Н2О; 48,8 – коэффициент, выражающий теплоту полного сгорания угля в расчете на 1 грамм-атом кислорода; 10,6 – коэффициент, учитывающий теплоту конденсации водяных паров, образующихся при сгорании органического вещества; m – число атомов кислорода, необходимое для полного сгорания органического вещества; n – число молей воды, образующихся при сгорании органического вещества; ∆ – поправочная величина. Для всех предельных органических соединений ∆ = 0; для непредельных ∆ > 0. Значение постоянно для всех членов данного гомологического ряда и растет с повышением непредельности соединения (∆С=С = 21 ккал/моль, ∆С≡С = 51 ккал/моль)
Расчет 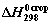 по Карашу Караш предложил общий метод вычисления стандартных теплот сгорания при 25ºС жидких органических соединений различных классов. Рассматривая любое органическое соединение как углеводород, в котором некоторое число атомов водорода замещено различными атомами и группами, и считая
по Карашу Караш предложил общий метод вычисления стандартных теплот сгорания при 25ºС жидких органических соединений различных классов. Рассматривая любое органическое соединение как углеводород, в котором некоторое число атомов водорода замещено различными атомами и группами, и считая 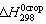 функцией числа электронов, перемещающихся при горении к атомам окислителя, Караш получил следующую расчетную формулу:
функцией числа электронов, перемещающихся при горении к атомам окислителя, Караш получил следующую расчетную формулу: 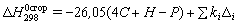 , ккал/моль, где 26,05 – теплота разрыва связей С–С, С–Н и последующего образования СО2 и Н2О; С – число атомов углерода в соединении; Н – число атомов водорода в соединении; Р – число частично смещенных электронов в соединении;
, ккал/моль, где 26,05 – теплота разрыва связей С–С, С–Н и последующего образования СО2 и Н2О; С – число атомов углерода в соединении; Н – число атомов водорода в соединении; Р – число частично смещенных электронов в соединении; 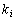 – число одноименных заместителей;
– число одноименных заместителей;  – соответствующая данному заместителю тепловая поправка.Частично смещать электроны в молекуле соединения могут только атомы сильных окислителей (кислород, галоген и т. д.), причем количество таких частично смещенных электронов обычно соответствует валентности атома окислителя в данной молекуле. Например, в С6Н6 р = 0, в С2Н5ОН р = 2, в С6Н5Сl р = 1 и т. д.Метод Караша является весьма приближенным, позволяющим получить лишь очень грубую оценку величины
– соответствующая данному заместителю тепловая поправка.Частично смещать электроны в молекуле соединения могут только атомы сильных окислителей (кислород, галоген и т. д.), причем количество таких частично смещенных электронов обычно соответствует валентности атома окислителя в данной молекуле. Например, в С6Н6 р = 0, в С2Н5ОН р = 2, в С6Н5Сl р = 1 и т. д.Метод Караша является весьма приближенным, позволяющим получить лишь очень грубую оценку величины 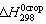 , к нему следует обращаться при полном отсутствии опытных данных.
, к нему следует обращаться при полном отсутствии опытных данных.
|
|
|
Расчет 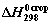 по Фросту
по Фросту
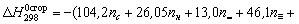
 ккал/моль; где
ккал/моль; где 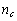 – число атомов углерода в соединении;
– число атомов углерода в соединении;  – число атомов водорода в соединении;
– число атомов водорода в соединении; 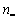 – число двойных связей в молекуле алкенов или в боковых цепях циклических соединений;
– число двойных связей в молекуле алкенов или в боковых цепях циклических соединений;  – число тройных связей в молекулах алкинов;
– число тройных связей в молекулах алкинов; 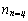 – число двойных связей в кольце цикленов;
– число двойных связей в кольце цикленов; 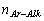 – число связей между арильной и алкильной группами;
– число связей между арильной и алкильной группами; 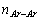 – число связей между арильными группами.
– число связей между арильными группами.
Расчет 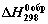 органических соединений по энергиям связи Теплоту образования газообразного вещества с использованием энергии связей можно найти по уравнению:
органических соединений по энергиям связи Теплоту образования газообразного вещества с использованием энергии связей можно найти по уравнению:
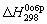 =
= 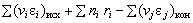 , где
, где 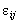 – энергия связи;
– энергия связи; 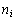 – число твердых атомов исходных элементов;
– число твердых атомов исходных элементов; 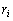 – соответствующая им теплота возгонки;
– соответствующая им теплота возгонки; 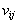 – стехиометрические коэффициенты в уравнении реакции.
– стехиометрические коэффициенты в уравнении реакции.
В частности зависимость теплового эффекта от температуры выражается уравнением Кирхгофа: 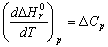 ,
, 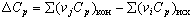
где 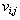 – стехиометрические коэффициенты в уравнении реакции;
– стехиометрические коэффициенты в уравнении реакции;  – теплоемкость конечных и исходных веществ.Очевидно, что при
– теплоемкость конечных и исходных веществ.Очевидно, что при 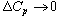 тепловой эфт не завт от Т. В связи с этим иногда в опред-х темпер-ых интервалах м пренебречь изм-ем теплоемкости. С учетом этих усл-й, интегрируя ур-е пределах от 298 К до Т при пост давлении, получаем:
тепловой эфт не завт от Т. В связи с этим иногда в опред-х темпер-ых интервалах м пренебречь изм-ем теплоемкости. С учетом этих усл-й, интегрируя ур-е пределах от 298 К до Т при пост давлении, получаем:  , где
, где  – изм-е теплоемкости веществ – уч-в р-и, получ-е при исп-и в расчетах средних теплоемкостей в-в в заданном интервале Т. В случае, когда создается необх-ь учесть изм-е теплоемкостей с Т, следует до интегрирования в у-е подставить выр-е
– изм-е теплоемкости веществ – уч-в р-и, получ-е при исп-и в расчетах средних теплоемкостей в-в в заданном интервале Т. В случае, когда создается необх-ь учесть изм-е теплоемкостей с Т, следует до интегрирования в у-е подставить выр-е 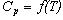 . Такая зав-ть в лит-ре обычно дается в виде темпер-го ряда, описываемого, например, уравнением
. Такая зав-ть в лит-ре обычно дается в виде темпер-го ряда, описываемого, например, уравнением 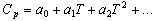 Однако, как известно, в результате х р меняется теплоемкость уча ри, что вырся урем:
Однако, как известно, в результате х р меняется теплоемкость уча ри, что вырся урем: 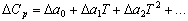 , где
, где  – разность сумм соотв-х коэф-в в
– разность сумм соотв-х коэф-в в 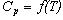 продуктов реакции и исходных веществ с учетом их стехиом коэф-в.
продуктов реакции и исходных веществ с учетом их стехиом коэф-в.
|
|
|
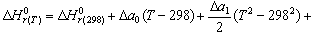
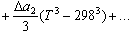 .
.
Зависимость ∆Н от Т
Зависимость теплового эффекта от температуры выражается уравнением Кирхгофа:
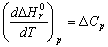 ,
, 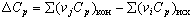
 – теплоемкость конечных и исх в-в.
– теплоемкость конечных и исх в-в.
При 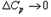 тепловой эф-т не зависит от Т. В опред-х темпер-ых интервалах м пренебречь изм-ем теплоемкости. Интегрируя ур-е (1) в пределах от 298 К до Т:
тепловой эф-т не зависит от Т. В опред-х темпер-ых интервалах м пренебречь изм-ем теплоемкости. Интегрируя ур-е (1) в пределах от 298 К до Т:
 (3)
(3)
где  – изм-е тепл-сти в-в – уч-ов р-и, полученное при исп-и в расчетах средних тепл-тей в-в в заданном интервале температур.
– изм-е тепл-сти в-в – уч-ов р-и, полученное при исп-и в расчетах средних тепл-тей в-в в заданном интервале температур.
Случай когда создается необх-сть учесть изм-е теплоемкостей с Т, следует до интегрирования в ур-е (1) подставить выр-е 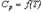 . В лит-ре зав-ть дается в виде температурного ряда:
. В лит-ре зав-ть дается в виде температурного ряда:
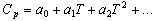 . (4)
. (4)
Т.к. в рез-те хим-й р-и меняется тепл-ть уч-ов р-и:
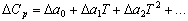 (5)
(5)
Подставив ур-е (5) в ур-е (1) и проинтегр-в его:
|
|
|


