 |
Структурные основы сокращения мышц. Поперечнополосатые мышцы
|
|
|
|
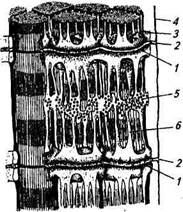
Строение поперечнополосатых мышц на различных уровнях можно представить схематически (рис. 2.22). Мышцы состоят из отдельных цилиндрических многоядерных клеток или, как чаще всего их называют, волокон, которые заключены в общем соединительнотканном футляре. Поперечнополосатые мышцы обычно начинаются от сухожилия или от другой соединительной ткани на
одной кости и заканчиваются
Перистое
| Мышца Параллельное Сухожилие |
| /__ Саркомер |
| 'ышечное волокно '^~~~2^линия Миофиб-рилла |
| Молекулы G-актина ZS--------- аявмвгаав» Т- F-актиновыи филамент |
| Миозиновые филаменты |



 в сухожилии или в соединительной ткани на другой кости. В некоторых мышцах направление всех волокон параллельно длинной оси мышцы — параллельно-волокнистый тип. В других мышцах они расположены косо, прикрепляясь с одной стороны к центральному сухожильному тяжу, а с другой — к наружному сухожильному футляру. Такое строение напоминает на продольном срезе мышцы перо птицы — перистый или полуперистый тип. Мышечные волокна в мышце тесно прилегают друг к другу, т. е. они работают параллельно друг другу. Диаметр волокон поперечнополосатых мышц варьирует от 5 до 100 мкм, а длина у крупных животных более 10 см. Необычные их размеры и строение объясняются тем, что мышечные волокна возникают из отдельных клеток — миобластов, сливающихся в миотрубочки, которые, в свою очередь, дифференцируются с образованием многоядерных, окруженных общей мембраной мышечных волокон. Каждое мышечное волокно состоит из множест-
в сухожилии или в соединительной ткани на другой кости. В некоторых мышцах направление всех волокон параллельно длинной оси мышцы — параллельно-волокнистый тип. В других мышцах они расположены косо, прикрепляясь с одной стороны к центральному сухожильному тяжу, а с другой — к наружному сухожильному футляру. Такое строение напоминает на продольном срезе мышцы перо птицы — перистый или полуперистый тип. Мышечные волокна в мышце тесно прилегают друг к другу, т. е. они работают параллельно друг другу. Диаметр волокон поперечнополосатых мышц варьирует от 5 до 100 мкм, а длина у крупных животных более 10 см. Необычные их размеры и строение объясняются тем, что мышечные волокна возникают из отдельных клеток — миобластов, сливающихся в миотрубочки, которые, в свою очередь, дифференцируются с образованием многоядерных, окруженных общей мембраной мышечных волокон. Каждое мышечное волокно состоит из множест-
Молекула миозина
Рис. 2.22. Строение поперечнополосатых ва параллельно расположен-мышц на различных уровнях организации НЫХ субъединиц — миофибрилл,
|
|
|
|
Рис. 2.23. Схема ультраструкгурной организации участка мышечного волокна поперечнополосатой мышцы:
1 — поперечная Г-трубочка; 2 — устье Г-трубоч-ки; 3 — боковая цистерна саркоплазматического ретикулума; 4— наружная мембрана мышечного волокна; 5 — фенестрированная муфта саркоплазматического ретикулума; 6— продольные элементы саркоплазматического ретикулума
включающих в себя повторяющиеся в продольном направлении блоки — саркомеры, отделенные друг от друга Z-пластинками. Саркомер миофибриллы представляет собой функциональную единицу поперечнополосатой мышцы. Миофибриллы отдельного мышечного волокна связаны таким образом, что расположение сар-комеров совпадает (см. рис. 2.22), и это создает картину поперечной «полосатости» под световым микроскопом. Отсюда и название этих мышц — «поперечнополосатые».
Чрезвычайно ценные данные о тонкой структуре поперечнополосатых мышц были получены с использованием электронной микроскопии. На электронных снимках видно, что Z-пластинка содержит а-актин — один из белков, который обнаружен у всех клеток, обладающих подвижностью. В обоих направлениях от Z-пластинки тянутся многочисленные тонкие нити (филаменты), состоящие главным образом из белка актина. Они контактируют с толстыми нитями, состоящими из белка миозина. Миозиновые филаменты образуют наиболее плотную часть саркомера — Л-диск (в световом микроскопе он выглядит темной полосой). Более светлый участок в центре Л-диска называют Я-зоной. В середине Я-зоны находится Л/-линия, в области которой локализованы ферменты, играющие важную роль в энергетическом метаболизме. По периметру каждой миофибриллы на уровне Z-пластинки идет окруженная мембраной поперечная трубочка (Г-трубочка) диаметром около 0,1 мкм (рис. 2.23). Она разветвляется таким образом, что соединяется с аналогичными трубочками, окружающими соседние миофибриллы на том же самом уровне. Система разветвленных трубочек в конечном счете достигает поверхности наружной мембраны мышечного волокна, где с ней соединяется, причем устье трубочки открывается во внеклеточное пространство в области Г-образного впячивания мембраны мышечного волокна. В дополнение к системе Г-трубочек в мышцах есть еще одна система, получившая название саркоплазматического ретикулума. Она обволакивает подобно полой манжете отдельно каждую мио-фибриллу от одной Z-пластинки до другой (см. рис. 2.23). Сарко-
|
|
|
|
| Головка |
| меромиозин' |
 ^л^^флЩяЩ^Щя.
^л^^флЩяЩ^Щя.
го перекрывания каждый миозиновый филамент окружен шестью актиновыми (тонкими) филаментами (рис. 2.24).
Актиновый филамент по своему строению напоминает две нитки бус, перекрученные в двойную спираль (рис. 2.24). Каждая бусинка — это мономерная молекула G-актина. Молекулы G-актина, полимеризуясь, образуют длинную двойную спираль /'-актина. Актиновые филаменты имеют длину 1 мкм и диаметр 8 нм и прикрепляются одним концом к компонентам, образующим Z-линию. В продольных бороздках актиновой спирали лежат нитевидные молекулы белка тропомиозина. К каждой молекуле тропомиозина прикреплен комплекс молекул глобулярных белков, получивших название «тропонины». Тропониновые комплексы содержат выступы вдоль актинового филамента с интервалом около 40 нм.
Миозиновый филамент (см. рис. 2.24) образует при полимеризации мономеры длиной около 150 нм и диаметром 2нм. На одном конце миозиновых молекул образуется двойная глобулярная головка. Длинная тонкая часть молекулы состоит из двух пептидных цепей, закрученных относительно друг друга на всем протяжении и подразделяющихся на шейку и хвост. Мономеры собираются в филамент так, что их головки, получившие название мостиков, выступают на поверхности филамента и располагаются вдоль его оси в виде двухнитчатой спирали. Расстояние между соседними мостиками вдоль оси спирали около 14 нм, а угол их смещения вокруг филамента 120°.
 Рис. 2.24. Схема ультраструктурной организации мио-фибрилл:
Рис. 2.24. Схема ультраструктурной организации мио-фибрилл:
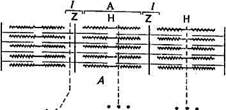
А — продольный и Б — поперечный срезы через миофиб-риллу; В — актиновый (тонкий) филамент; Г— схема молекулы миозина; Д— схема расположения поперечных мостиков на толстом филаменте; /— светлый диск; А — темный диск; Z— пластинка; Н— средняя зона
|
|
|
плазматический ретикулум, окружающий каждый отдельный сар-комер, состоит из ограниченного мембраной объема, отделенного от внутриклеточной среды мышечного волокна (миоплазмы). Концевые цистерны саркоплазматического ретикулума вступают в тесный контакт с Г-трубочкой и как бы сдавливают ее между собой, но их полости не соединяются (см. рис. 2.23). Мембрана мышечного волокна — плазмалемма сходна по своему строению с нервной мембраной. Ее особенность состоит в том, что она дает регулярные впя-чивания (трубки диаметром 50 нм) приблизительно на уровне границы А- и /-дисков, куда открываются Г-трубочки.
Ультраструктура филаментов. На поперечном срезе /-дисков видны только актиновые филаменты, а на поперечном срезе Я-зоны — только миозиновые. В то же время на участке взаимно-
ТЕОРИЯ СКОЛЬЖЕНИЯ НИТЕЙ
Было установлено, что саркомеры изменяют свою длину при сокращении или растяжении мышцы. При этом ширина Л-дисков в обоих случаях не меняется. В то же время при укорочении мышцы /-диски и //-зона становятся более узкими и, наоборот, при растяжении расширяются. Электронно-микроскопические исследования структуры саркомера при укорочении и растяжении мышцы обнаружили, что миозиновые (Л-диск) и актиновые (/-диск) филаменты не изменяют своей длины при изменении протяженности саркомера (рис. 2.25). Меняется лишь ширина участка взаимного перекрывания актиновых и миозиновых компонентов. Эти факты легли в основу теории, объясняющей мышечное сокращение, предложенной в начале 50-х годов XX в. X. Хаксли и А. Хаксли — теории скольжения нитей. Согласно данной теории укорочение саркомера, а следовательно, и мышечного волокна в момент сокращения происходит благодаря скольжению тонких (актиновых) нитей относительно толстых (миозиновых). Укорочение заканчивается, когда актиновые филаменты максимально втягиваются по направлению к центру Л-диска. При рас-
|
|
|
Н-зона I-дис к А-диск Актиновый фи/юмент
 Z-Линия I------- 1 I------------ II---------------- <Z-линия... mi.... J,., и, i
Z-Линия I------- 1 I------------ II---------------- <Z-линия... mi.... J,., и, i
| / hfADP Прикрепление миозиновой М4 головки^ к актину ' |
Мостиковый''1 1у£,, 4 0
шарнир\ _____ *» Миозиновая

|
-АТР
г,.д„„-„» лго\ Отделение Гидролиз А ГЯ\^ головки
В
Рис. 2.25. Гипотеза скользящих нитей:
А — взаимоотношения миофиламентов в процессе укорочения двух саркомеров; Б — модель функционирования поперечного мостика, согласно которой на миозиновой головке имеется 4 центра связывания. Эти центры от Мх до Щ последовательно (слева направо) взаимодействуют с центрами актинового филамента; В — общая схема цикла работы поперечного мостика
слаблении мышцы область взаимного перекрытия филаментов уменьшается. Скольжение филаментов относительно друг друга происходит под действием силы, которая возникает при последовательном связывании нескольких центров миозиновой головки с определенными участками на актиновых филаментах. Механизм сокращения состоит в перемещении (протягивании) актиновых нитей вдоль миозиновых к центру саркомера за счет «гребных» движений головок миозина, периодически прикрепляющихся к актиновым филаментам, т. е. за счет поперечных ак-томиозиновых мостиков. Амплитуда движений составляет около 20 нм, а частота — 5...50 кол/с. Каждый мостик то соединяется и тянет нить, то отсоединяется и ждет «условий» для нового прикрепления. Поскольку огромное количество мостиков работает несинхронно, их общая «тяга» в результате оказывается равномерной во времени.
Согласно имеющимся экспериментальным данным механизм цикличности работы миозиновых мостиков представляется следующим образом. В покоящейся мышце мостик обладает определенной энергией, запасенной в результате фосфорилирования миозина, но он не может соединиться с актиновой спиралью, поскольку между ними в продольных бороздках спирали находятся нити белка тропомиозина с глобулой тропонина. При возбужде-80
нии мышцы во внутриклеточном пространстве увеличивается концентрация ионов кальция, который в присутствии АТФ вызывает изменения в конформации тропонина, в результате чего смещается нить тропомиозина и головка миозина получает возможность соединиться с актином. Соединение головки фосфорилированно-го миозина с актином приводит к сгибанию головки и перемещению нити актина на один шаг (20 нм) с последующим разрывом мостика. Энергию на такой единичный акт дает разрыв макро-эргической фосфатной связи, включенной фосфорилактомио-зином. Затем происходит уменьшение локальной концентрации ионов кальция и удаление их от тропонинового комплекса. Тро-помиозин снова блокирует актин, а миозин, в свою очередь, фос-форилируется за счет АТФ. Здесь важно отметить, что АТФ наряду со снабжением энергией системы для ее дальнейшей работы способствует временному разобщению нитей и делает возможным растяжение мышцы под влиянием внешних сил. При исчезновении АТФ из миоплазмы развивается непрерывное сокращение — контрактура.
|
|
|
|
|
|


