 |
Вычисления в гравиметрическом анализе.
|
|
|
|
Гравиметирическое определение состоит из ряда этапов: отбор пробы, растворение пробы, получение осаждаемой формы, фильтрование осадка и т.д
На некоторых этапах определения необходимы предварительные расчеты. Так следует рассчитать величину навески или объем пробы, а так же количество осадителя, которые необходимо взять для анализа, объем промывной жидкости, потери при промывании осадка. Кроме того необходимо вычислить результат с определенной точностью.
Основные виды расчетов приведены в настоящем разделе.
Расчет начальной навески или объема пробы. Масса навески или объем жидкой пробы для анализа зависят от массовой доли определяемого компонента, массы осаждаемой и гравиметрической форм, чувствительности весов.
При выполнении одного определения рассчитать величину навески можно по формуле:

где – g – искомая навеска, г.;
m – масса гравиметрической формы, г.;
p – массовая доля определяемого компонента, %;
F – гравиметрический фактор.
Масса гравиметрической формы определяется, с одной стороны погрешностью весов, с другой стороны оптимальной массой осаждаемой формы. Погрешность аналитических весов составляет 1·10-4 г. Относительная погрешность гравиметрических определений не должна превышать 0,1 %, погрешность взвешивания должна составлять не более 0,1 % от минимальной массы гравиметрической формы. Отсюда

 т.е.
т.е.  г.
г.
Оптимальная масса осаждаемой формы в зависимости от структуры осадка может колебаться в следующих интервалах:
| Вид осадка | Оптимальная масса осадка, г. |
Аморфный 
| 0,07-0,1 |
Кристаллический, легкий 
| 0,1-0,15 |
Кристаллический, тяжелый 
| 0,2-0,4 |
Кристаллический, очень тяжелый 
| До 0,5 |
Расчет начальной навески или объема пробы носит приближенный характер, что обеспечивается численными значениями величин с двумя значащими цифрами.
|
|
|
Пример 1. Какую навеску руды, содержащую около 20 % железа, нужно взять для определения железа в виде оксида железа.
Решение: Осаждаемой формой при определении является гидрат окиси железа 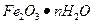 , относящийся к аморфным осадкам. Примем массу осаждаемой формы равной 0,1 г. Масса гравиметрической формы меньше вследствие потери воды при прокаливании. Однако минимальная масса гравиметрической формы должна быть не менее 0,1 г, поэтому полагаем m=0,1 г. F находим по таблицам. (см. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.)
, относящийся к аморфным осадкам. Примем массу осаждаемой формы равной 0,1 г. Масса гравиметрической формы меньше вследствие потери воды при прокаливании. Однако минимальная масса гравиметрической формы должна быть не менее 0,1 г, поэтому полагаем m=0,1 г. F находим по таблицам. (см. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.)
 г.
г.
Пример 2. Рассчитайте навеску почвы для определения влажности, если предположительная влажность не превышает 8 %.
Решение: Минимальная потеря массы при высушивании не должна быть меньше 0,1 г, что составляет 8 % навески, следовательно
 г.
г.
Пример 3. Какой объем раствора, содержащего 0,9 % (по массе) хлорида натрия (ρ=1 г/см3), следует взять для анализа, чтобы масса весовой формы  составила 0,36 г.
составила 0,36 г.
Решение: Составим схему определения и найдем стехиометрические соотношения между элементами схемы  .
.
Найдем сколько потребуется хлорида натрия для получения 0,36 г. хлорида серебра
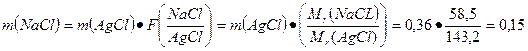 г.
г.
Учитывая приближенный характер вычислений примем плотность раствора равной 1,0 мг/см3 и рассчитаем объем раствора
 мл
мл
Расчет объема раствора осадителя. Принято считать осаждение практически полным, если количество осаждаемой формы, остающейся в растворе, не превышает погрешности взвешивания (1·10-4 г.). Для более полного выделения осаждаемого иона добавляют избыток осадителя по сравнению с рассчитанной по уравнению реакции.
Если осадитель летучий, то рекомендуется использовать 2-3-кратный избыток, в случае же нелетучего осадителя ограничиваются введением 30-50 %-ного избытка.
|
|
|
Пример 4. Сколько миллилитров 5 %-ного раствора нитрата серебра необходимо для количественного осаждения хлорида серебра из 200 мл 0,01 М раствора соляной кислоты?
Решение: Рассчитываем стехиометрическое количество нитрата серебра по уравнению реакции:

в 200 мл раствора 1·10-2 М раствора соляной кислоты содержится 0,073 г. соляной кислоты, поэтому


Учитывая приближенный характер вычислений, принимаем плотность 5%-ного раствора нитрата серебра равной единице и находим
 мл.
мл.
Поскольку нитрат серебра – нелетучие вещество, для количественного осаждения холорид-ионов следует взять 30%-ный избыток осадителя. Следовательно,
 мл.
мл.
Пример 5. Какой объем 0,1 М раствора соляной кислоты необходимо взять для количественного осаждения хлорида серебра из 200 мл раствора, содержащего 0,10 г нитрата серебра.
Решение. Вычисляем необходимое количество соляной кислоты по уравнению реакции осаждения (см. пример 4).
 г.
г.
Учитывая приближенный характер вычислений принимаем плотность 0,1 М раствора соляной кислоты равной единице, поэтому
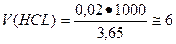 мл.
мл.
Поскольку соляная кислота летучая, для полного осаждения ионов серебра можно взять ее в 2 раза больше, т.е. 12 мл.
Расчет объема промывной жидкости. Концентрация примесей cn, остающихся в осадке после n-го промывания, выражается формулой:

где – с0- концентрация примесей в исходном растворе;
V- объем одной порции промывной жидкости;
V0 – объем жидкости, удерживаемой осадком;
Зная с0, можно вычислить массу примесей в осадке:
 (моль)
(моль)
или
 (мол. Масса примеси, г.)
(мол. Масса примеси, г.)
Теоретически рассчитанное количество примеси несколько меньше действительно остающегося в осадке, так как примеси удерживаются осадком и вследствие окклюзии.
Использовать большой объем промывной жидкости нельзя, поскольку потери за счет растворимости могут превысить погрешность взвешивания. Можно рассчитать потери при промывании за счет растворимости осадка, исходя из произведения растворимости и состава промывной жидкости.
Пример 6. Сравните количество примесей, оставшихся в осадке, при промывании сульфата бария 100 мл воды порциями по 10 мл и по 20 мл, если объем удерживаемой воды равен 1 мл, а концентрация примесей в исходном растворе составляет 1·10-2 М.
Решение. Находим концентрацию примесей, оставшихся в осадке после
|
|
|
- десятикратного промывания:
 М
М
- пятикратного промывания:
 М
М
Промывание десятью порциями, меньшими по объему, эффективнее, чем промывание пятью порциями большего объема.
Пример 7. Какое максимальное количество воды можно использовать доля промывания осадка сульфата бария массой 1 г?
Решение: Погрешность гравиметрического определения не должна превышать 0,1 %; таким образом, потеря осадка должна быть не более 1·10--3 г или 4·10-6 М. Рассчитываем растворимость сульфата бария в воде (принимая коэффициенты активности равными единице)
 М
М
следовательно объем воды для промывания не может быть больше, чем
 л.
л.
Расчет потерь при промывании осадков. Этот расчет выполняют на основе закона действия масс применительно к равновесиям растворимости осадков в водных растворах. Обычно применяют допустимую потерю массы осадка не более 1·10-4 г, чтобы она не сказывалась на результатах взвешивания. Поскольку численные значения величины произведений растворимости (Ks0) известны с погрешностью 5-10 % (см. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.), удовлетворительную достоверность численных значений в расчетах получают при использовании 1-2-х значащих цифр.
Пример 8. Сколько граммов свинца будет потеряно за счет растворимости сульфата свинца при осаждении из 100 мл 1,00·10-3 М раствора нитрата свинца эквивалентным, полуторакратным избытком серной кислоты.
Решение. Реакция осаждения свинца:  . Для расчета воспользуемся произведением растворимости, пренебрегая изменением объема раствора при осаждении и реакцией образования гидросульфат-ионов.
. Для расчета воспользуемся произведением растворимости, пренебрегая изменением объема раствора при осаждении и реакцией образования гидросульфат-ионов.
При добавлении эквивалентного количества серной кислоты
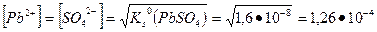 М.
М.
Это соответствует содержанию свинца в 100 мл раствора:
 г.
г.
В присутствии избытка осадителя:

Условие полуторакратного избытка серной кислоты означает, что концентрация сульфат-иона в растворе равна 2,5·10-3 М. Следовательно,
 М.
М.
Или в пересчете на 100 мл раствора
 г.
г.
Пример 9. Рассчитайте потери при промывании осадка гидроксида железа (в граммах) при промывании 0,2 л аммиачного буферного раствора (0,125 М аммиака и 1,25 М хлорида аммония).
|
|
|
Решение. Задача сводится к расчету растворимости гидроксида железа при данной концентрации гидроксид-ионов. Вычисляем концентрацию гидроксид-ионов при заданных концентрациях компонентов буферного раствора:
 М.
М.
Находим растворимость гидроксида железа (принимая коэффициенты активности равными единице):
 М.
М.
С учетом объема промывной жидкости рассчитываем потерю осадка:
 г.
г.
Пример 10. Сколько граммов кальция будет потеряно при промывании моногидрата оксалата кальция 0,2 л воды и таким же объемом 0,1 %-ного раствора оксалата аммония?
Решение. Осадок частично растворяется в промывной жидкости, поэтому задача сводится к расчету растворимости осадка в воде в присутствии одноименного иона. Пренебрегаем влиянием ионной силы и протеканием конкурирующих химических реакций. Если осадок промывают водой то,
 М.
М.
Если промывают раствором оксалата аммония, то
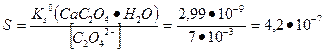 М.
М.
С учетом объема промывной жидкости потери из-за растворимости при промывании водой составляют:
 г.
г.
Обработка результатов гравиметрического анализа. Конечным этапом гравиметрического анализа является расчет результатов определения. При этом следует обратить внимание, что достоверность вычисленного результата должна соответствовать наименьшей достоверности измеренных величин.
Содержание массовой доли (ω) определяемого компонента в анализируемом образце рассчитывается по формуле:

где – F- гравиметрический фактор, который отражает содержание определяемого
компонента в гравиметрической форме и выражается формулой:
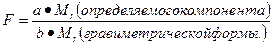
где – a, b – стехиометрические коэффициенты при определяемом элементе в
гравиметрической форме и определяемом компоненте соответственно.
Пример 11. Рассчитать гравиметрический фактор при определении магния в виде фосфата магния-аммония.
Решение. Гравиметрической формой в данном случае служит пирофосфат магния  .
.


Пример 12. Вычислите гравиметрический фактор при определении калия по схеме:
 .
.
Решение. Находим стехиометрические соотношения между соединениями схемы:

Определяем гравиметрический фактор:

Пример 13. Каково содержание оксида кальция в известняке, если при определении кальция из навески 0,4000 г получено 0,4340 г сульфата кальция?
Решение. Находим стехиометрические соотношения: 
Находимгравиметрический фактор:

Рассчитываем содержание оксида кальция в изветняке.

Пример 14. Из 25,00 мл раствора сульфата меди получен осадок  массой 0,2144 г. Вычислите массовую концентрацию ионов в растворе.
массой 0,2144 г. Вычислите массовую концентрацию ионов в растворе.
|
|
|
Решение. Находим стехиометрические соотношения: 

Находим массу ионов меди:

Определяем массовую концентрацию тонов меди:
 г.
г.
Пересчет результатов анализа на сухое вещество. Во влажном или воздушно-сухом состоянии в веществе присутствует внешняя (гигроскопическая) влага. Удаляя эту влагу высушиванием при 10-110 ºС получают сухое (абсолютно сухое) вещество.
Различают также кристаллизационную (кристаллогидратную, гидратную) воду, которая входит в состав химических соединений и удаляется при более высоких температурах, например  ,
, 
Для вычисления массы компонента в сухом веществе его массу относя к массе сухой пробы.
Пример15. Для анализа взяли 0,1534 г технического сульфата натрия и после обработки его хлоридом бария получили 0,2233 г сульфата бария. Рассчитайте массовую долю сульфата натрия во влажной и сухой навеске соли, если влажность составляет 4,25 %.
Решение. Определяем массу сульфата натрия по полученному осадку сульфата бария:

Определяем массовую долю сульфата во влажной навеске:

Определяем массовую долю сульфата в сухой навеске:

|
|
|


