 |
Ионно-электронный метод (метод полуреакций)
|
|
|
|
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления. При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде). В ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы: H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
- Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
- Запишем уравнение в ионном виде, сократив те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
- Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+, образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
- Находим коэффициент для окислителя и восстановителя, учитывая, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O ¦2 окислитель, процесс восстановления
|
|
|
SO32- + H2O — 2e— = SO42- + 2H+ ¦5 восстановитель, процесс окисления
42)Электролиз -физико-химический процесс, состоящий в разложение вещества на составные части при прохождении через его раствор электрического тока
Этот окислительно-восстановительный процесс протекает на электродах (проводник) при прохождении постоянного электрического тока через растворы или расплавы электролитов. На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
Примеры электролиз расплавов:
  Электролиз воды
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (напримерLi+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода
Примеры электролиза растворов солей: Электролиз воды
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (напримерLi+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода
Примеры электролиза растворов солей:
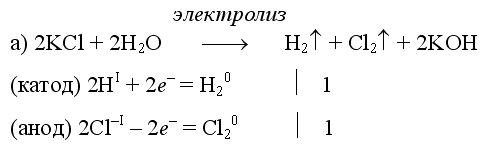 (на аноде окисляются анионы Сl−, а не кислород O−II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород)
(на аноде окисляются анионы Сl−, а не кислород O−II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород)
 (на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде).
Таким образом, электролиз - это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
(на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде).
Таким образом, электролиз - это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
|
|
|
|
43)Электродные потенциалы. Уравнение Нернста. Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Вывод уравнения Нернста
 , где
, где
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
R — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T — абсолютная температура;
F — постоянная Фарадея, равная 96485,35 Кл·моль−1;
т — число моль электронов, участвующих в процессе;
 и
и 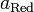 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при  получим
получим

Гальванический элемент.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ- химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно-восстановительной реакцией. В состав гальванического элемента входят два разнородных электрода (один- содержащий окислитель, другой - восстановитель), контактирующие с электролитом. Различают гальванические элементы одноразового использования (т. н. первичные элементы, напр.Лекланше элемент), многоразового действия (электрические аккумуляторы) и с непрерывной подачей реагентов (топливные элементы). Ранее термин"гальванический элемент" относился только к первичным элементам.
|
|
|
ЭДС гальванического элемента определяется как разность электродных потенциалов.
По уравнению НЕРНСТА

|
|
|


