 |
При установлении метаболических нарушений рассчитываются сопутствующие компенсаторные дыхательные отклонения
|
|
|
|
КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ.
Содержание:
- Общие понятия.
- Буферные системы.
- Компенсаторные механизмы.
1. Согласно определению Бренстеда-Лоури, кислоты – это вещества, диссоциирующие с образованием свободных ионов H+, т. е. являющиеся донором протона, а о снования – вещества, присоединяющие ионы водорода (акцепторы протона).
Сильными кислотами считаются кислоты, подвергающие полной диссоциации, необратимо и легко отдающие [H+], например, HCl. Слабые – частично диссоциирующие, обратимо отдающие [H+], например, H2CO3. Сила оснований, соответственно, определяется способностью активно связывать ионы водорода. Чем сильнее основание, тем больше оно снижает концентрацию [H+] в растворе, например, OH-. Классический пример слабого основания – HCO3-, присоединяющее ион водорода значительно слабее, чем OH-. В организме человека большинство химических соединений представлено слабыми кислотами и слабыми основаниями.
Главными регуляторами кислотно-щелочного равновесия являются углекислый газ и ионы водорода. Водород играет основную роль в образовании кислот и оснований, его концентрация должна находиться в строгих пределах, контролируемых организмом.
При отклонении количества ионов водорода от нормального возникают сбои в работе ферментных систем и функциональных белков, порой несовместимые с жизнью.
Некоторое количество [H+] образуется в результате метаболизма биологических веществ – углеводов, жиров и белков. Классический пример биосинтеза протонов – аэробный гликолиз:
C6H12O6 + 6O2 → 6CO2 + 6H2O
Углекислый газ (CO2) фактически является потенциальной кислотой, и, хотя к нему не присоединён ион водорода, он является основным источником [H+]. СO2 вступает в реакцию с водой, образуя угольную кислоту - H2CO3, которая тотчас диссоциирует с образованием протонов:
|
|
|
CO2 + H2O → H2CO3
H2CO3→ H+ + HCO3-
Данная реакция будет двунаправленной, степень отклонения её зависит от концентрации конечных продуктов:
CO2 + H2O ↔ H2CO3 ↔H+ + HCO3-
Таким образом, при увеличении уровня углекислого газа реакция сдвигается вправо, что приводит к повышению количества водородных ионов.
Второстепенную роль в образовании [Н+] играет превращение двухвалентного железа в трехвалентное (соотношение окисленного и восстановленного гемоглобина):
2Fe++ + 1/2O2 + 2H+ ↔ 2Fe+++ + H2O
Реакция среды любого раствора зависит от количества ионов водорода в растворе. Количество [H+] в артериальной крови составляет 40 нэкв/л. Нормальные колебания концентрации ионов водорода не выходят за пределы 3 – 5 нэкв/л. Количество H+ выше 160 нэкв/л и ниже 10 нэкв/л является несовместимым с жизнью. Нормальные значения pH плазмы варьируют от 7,35 до 7,45.
| pH | [H+] нмоль/л |
| 6,80 | |
| 6,90 | |
| 7,00 | |
| 7,10 | |
| 7,20 | |
| 7,30 | |
| 7,36 | |
| 7,37 | |
| 7,38 | |
| 7,39 | |
| 7,40 | |
| 7,41 | |
| 7,42 | |
| 7,43 | |
| 7,44 | |
| 7,50 | |
| 7,60 | |
| 7,70 | |
| 7,80 | |
| 8,00 |
Буферные системы
– биохимические комплексы, обеспечивающие постоянство pH путем отдачи либо присоединения ионов водорода. Буферные системы не удаляют H+ из организма, а «связывают» его своим щелочным компонентом до окончательного восстановления КЩС.
Буфер + H+ ↔ H Буфер
Водород взаимодействует с буфером, образуя слабую кислоту. Так как реакция является двунаправленной, то увеличение концентрации водорода вызывает смещение реакции вправо, уменьшение – влево.
В физиологических условиях организмом ежедневно продуцируется около 80 мэкв ионов водорода в составе нелетучих (фиксированных) кислот. К таким кислотам относятся серная, фосфорная, образующиеся в результате окисления тканевых белков и фосфолипидов, а также небольшое количество ацетоацетата и лактата, появляющиеся в результате неполного окисления углеводов и жиров.
|
|
|
Основными буферными системами являются:
-бикарбонатный буфер [H2CO3/HCO3-] Является основным буфером крови во внешнем пространстве (до 53% от всех буферных систем)
-гемоглобиновый буфер [HbH/Hb-] - 35% от общего количества, является внутриклеточным буфером
-белковый буфер [HPr/Pr-] - 7% от общего количества
-фосфатный буфер [H2PO4-/HPO4-] – 5% от общего количества. Действует преимущественно в костях и моче.
-аммиак/ион аммония [NH3/NH4+] –действует преимущественно в моче.
Буферные системы также делятся на внутриклеточные и внеклеточные. Около 60-70% от общего количества буферов организма приходятся на внутриклеточные, большинство из которых представлены внутриклеточными белками.
Любая буферная система организма состоит из двух частей
-слабой кислоты
-соли слабой кислоты, образованные сильным основанием.
Параметры буферных систем:
1. Диапазон буферного действия – это диапазон pH, в котором будет эффективен данный буфер. Характеризуется величиной pK. Так, для бикарбонатного буфера pK будет равно 6,1 ± 1.
2. Буферная ёмкость – это количество кислоты или основания, которое необходимо добавить в буфер, чтобы изменить pH на 1 ммоль/л на ед. pH. Зависит от молярной концентрации буферной системы и от величины pK.
Буферные системы не действуют каждая в отдельности, их работа происходит по принципу сохранения одинаковой концентрации ионов водорода во всех системах. При изменении в одной из буферных систем происходит изменение баланса остальных благодаря сдвигу ионов водорода между ними.
БИКАРБОНАТНЫЙ БУФЕР:
Бикарбонатный буфер представляет собой пару слабой кислоты H2CO3 и слабого основания - бикарбоната, а точнее его соли - NaHCO3.
Константа диссоциации бикарбонатного буфера (pK) равна 6,1. Это далеко от среднего значения pH, поэтому мощность бикарбонатного буфера не слишком велика. Тем не менее, бикарбонатный буфер является наиболее эффективной буферной системой. Во первых, концентрация бикарбоната во внеклеточной жидкости довольно высока, во-вторых, оба компонента буферной пары легко контролируются дыхательной (CO2) и мочевыделительной (HCO3-) системами. Тонкий баланс pH возможен в основном только благодаря способности легких и почек изменять соотношение H2CO3/NaHCO3 (CO2/HCO3-).
|
|
|
Допустим, в буферную систему попала сильная кислота, например, HCL, которая в водном растворе диссоциирует на H+ и Cl-. Имеющийся в бикарбонатном буфере HCO3- («летучий буфер») присоединяет ионы водорода с образованием H2CO3, который, в свою очередь, диссоциирует на воду и углекислый газ. Натрий из бикарбонатного буфера присоединяет оставшийся ион хлора. В целом данная реакция выглядит так:
1. NaHCO3 → Na+ + HCO3-
2. HCL → H+ + Cl-
3. H+ + HCO3- → H2CO3 → H2O + CO2
4. Na+ + Cl- → NaCl
В результате формируется больше угольной кислоты, что в свою очередь увеличивает продукцию углекислого газа и воды. Физиологический смысл этой реакции заключается в том, что поступившая сильная кислота HCl реагирует с HCO3-, превращаясь в слабую кислоту H2CO3. Угольная кислота диссоциирует на H2O и CO2. Избыток CO2 эффективно выводится легкими, причем снижение уровня HCO3- будет отражать количество добавленной кислоты.
Пример 1.
Если количество соляной кислоты будет равно 5 ммоль/л, то количество оставшегося бикарбоната будет равно разности [HCO3-]норма и N, где N – количество добавленной кислоты, то есть: [HCO3-]остаток = 24 ммоль/л – 5 ммоль/л = 19 ммоль/л.
или
5 ммоль/л H+ + 24 ммоль/л HCO3- → H2CO3 → 5 ммоль/л CO2 + H2O + 19 ммоль/л HCO3-
Образовавшийся в ходе реакции CO2 при не нарушенной функции легких выделяется в атмосферу, так что величина PaCO2 не изменится. Помимо того, развивающаяся при ацидозе гипервентиляция будет приводить к гипокарбии. Следовательно, бикарбонатный буфер эффективен для компенсации метаболического, но не респираторного, ацидоза.
Если во внеклеточную жидкость попадает сильное основание, например, NaOH, реакция будет следующей:
NaOH + H2CO3 → NaHCO3 + H2O
Физиологическая роль этой реакции заключается в образовании слабого основания NaHCO3 из более сильного NaOH.
Уменьшение количества H2CO3 в этом случае приводит к сдвигу реакции диссоциации угольной кислоты вправо:
|
|
|
CO2 + H2O → H2CO3 →H+ + ↑HCO3-
+ +
NaOH Na+
Сдвиг диссоциации H2CO3 вправо приводит к снижению количества CO2 в крови. Углекислый газ здесь расходуется на восстановление прежнего уровня угольной кислоты. Уменьшение CO2 приводит к снижению активности дыхательного центра, что вызывает гиповентиляцию. Гиповентиляция замедляет элиминацию углекислого газа, восстанавливая его прежние значения. Избыток образовавшегося бикарбоната эффективно выводится почками.
ГЕМОГЛОБИНОВЫЙ БУФЕР:
Гемоглобиновый буфер является вторым по значимости и мощности буфером после бикарбонатного.В отличие от бикарбонатного, в состоянии нейтрализовать как нелетучие, так и летучие кислоты. Окисленный гемоглобин ведёт себя как кислота, увеличивая концентрацию ионов водорода, а восстановленный (дезоксигенированный) – как основание, нейтрализуя H+. Таким образом, кислотно-основные свойства гемоглобина зависят от степени его оксигенации.
H+ + HbO2 ↔ HbH+ + O2
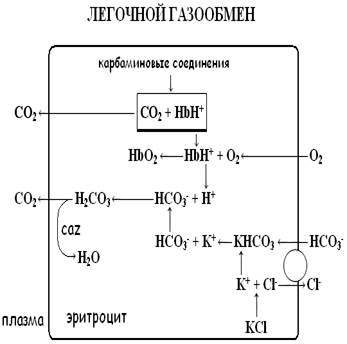
Увеличение концентрации ионов водорода вызывает смещение реакции вправо, снижая связывание кислорода с гемоглобином и облегчая его отдачу в тканях – эффект Бора (Bohr effect). При развитии ацидоза эффект Бора компенсирует дефицит кислорода в тканях путём увеличением его отдачи. Таким образом, буферная и транспортная функции гемоглобина находятся в тесной взаимосвязи (см. рис. 1).
В венозных капиллярах физически растворённый CO2 поступает в эритроциты из плазмы, где под действием фермента карбоангидразы (CAZ) вступает в связь с водой и образует угольную кислоту – H2CO3. Угольная кислота диссоциирует на бикарбонат и ион водорода. В эритроцитах бикарбонат соединяется с калием, образуя бикарбонатную соль:
HCO3- + K+ → KHCO3
При снижении концентрации бикарбоната в плазме процесс носит обратный характер, высвобождая HCO3-. Бикарбонат диффундирует обратно в плазму, а для поддержания электронейтральности и компенсации утечки анионов в эритроциты из плазмы поступают ионы Cl-.
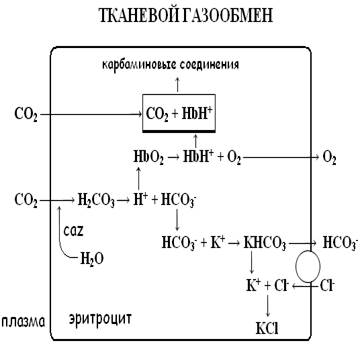
В легочных капиллярах все происходит наоборот - ионы бикарбоната поступают в эритроциты, обмениваясь на Cl-.. Процесс обеспечивается работой протеинового обменника, обозначенного на рисунке 1 кругом. Обменное перемещение ионов хлора в эритроците называется хлоридным сдвигом Гамбургера.
Вошедшие в эритроциты ионы хлора соединяются с калием, образуя – KCl, сохраняя электронейтральное состояние клетки.
В легочных капиллярах поступивший в эритроциты бикарбонат соединяется с H+, образуя H2CO3. Образовавшийся в результате CO2 диффундирует в альвеолы, элиминируясь из организма с выдыхаемым воздухом.
|
|
|
Чем ниже сатурация гемоглобина венозной крови кислородом, тем больше в ней восстановленного гемоглобина, и, следовательно, концентрация бикарбоната и BE будет увеличена по сравнению со значениями артериальной крови.
ФОСФАТНЫЙ БУФЕР:
Фосфатный буфер играет главную роль в буферировании мочи и внутриклеточной жидкости.
Основные элементы фосфатного буфера – H2PO4 и HPO4-.
Механизм действия фосфатного буфера аналогичен работе бикарбонатной буферной системы: поступивший ион водорода от сильной кислоты соединяется с HPO4- образуя H2PO4. При добавлении в систему щелочи происходит обратная реакция с образованием HPO4- и H2O из H2PO4 и OH-.
Роль фосфатного буфера заключается в конверсии сильных щелочей и кислот в более слабые соединения.
pK фосфатного буфера равна 6,8, что ближе к среднему значению pH по сравнению с pK бикарбонатного буфера. Несмотря на то, что сила фосфатного буфера выше, чем у бикарбонатного, его роль в буферировании во внеклеточной жидкости невелика, так как общая концентрация фосфатов в крови составляет около 8% от концентрации бикарбоната.
В почках фосфатный буфер особенно важен, так как, во-первых, количество фосфатов в моче достаточно велико, а во вторых, pH канальцевой жидкости ниже, чем pH плазмы, приближаясь к pK фосфатной буферной системы.
Во внутриклеточной жидкости концентрация фосфатов выше, чем во внеклеточной, а pH внутри клетки несколько ниже, чем снаружи, что обеспечивает эффективность фосфатного буфера как внутриклеточного.
3. Компенсаторные механизмы:
Компенсаторные механизмы при нарушениях КЩС включаются последовательно в зависимости от мощности и эффективности буферной системы. Выделяют три основные физиологические системы, регулирующие баланс ионов водорода:
· непосредственно буферные системы жидкостного компартмента организма;
· дыхательная система (респираторный центр);
· мочевыделительная система (почки).
Практически немедленно развивается действие бикарбонатного буфера в плазме, затем – в интерстициальной жидкости. Для полного развития действия внутриклеточных буферов необходимо несколько часов.
Время реагирования механизмов компенсации нарушений КЩС различно:
1. Внеклеточное буферирование: 10-15 минут. Осуществляется с помощью бикарбонатного буфера.
2. Внутриклеточное буферирование: 2-4 часа. Осуществляется преимущественно за счет гемоглобинового буфера.
3. Респираторная компенсация: 3-5 часов (максимальная – 12-24 часа).
4. Почечная компенсация: 6-8 часов начало (максимум – 5-7 дней).
РЕСПИРАТОРНАЯ КОМПЕНСАЦИЯ
Регуляция дыхания происходит двумя путями:
· по «отклонению» (центральная регуляция) - управляется количеством ионов водорода в цереброспинальной жидкости;
· по «возмущению» - (периферическая регуляция) - контролируется периферическими хеморецепторами, располагающимися в каротидных тельцах общих сонных артерий, связана с колебаниями PaO2 в плазме.
Дыхание в норме регулируется цент ральными хеморецепторами, располагающимися в продолговатом мозге на дне IV желудочка Непосредственно хеморецепторы продолговатого мозга реагируют на изменения концентрации ионов водорода в цереброспинальной жидкости (ЦСЖ), но так как водород практически не проникает через ГЭБ, то основную регуляторную роль оказывает физически растворённый в плазме CO2 (PaCO2). Нормальные значения PaCO2 находятся в пределах 35–45 mmHg. Уровню PaCO2 40 mmHg соответствует 1,2 моль/л физически растворенного CO2.
Альвеолярная вентиляция влияет на количество ионов водорода посредством элиминации CO2, но и изменение количества H+ также вызывает изменение альвеолярной вентиляции. Так, метаболический ацидоз с pH 7,0 увеличивает альвеолярную вентиляцию в 4-5 раз.
Проникая через ГЭБ, CO2 сдвигает реакцию диссоциации угольной кислоты вправо:
CO2 + H2O ↔ H2CO3 ↔H+ + HCO3-
| Бикарбонатный буфер является единственным буфером цереброспинальной жидкости, в основном благодаря тому, что ГЭБ является непроницаемым для подавляющего большинства веществ. К тому же в тканях головного мозга происходят интенсивные метаболические процессы, продукт местного аэробного метаболизма CO2 в большом количестве поступает непосредственно в ЦСЖ, влияя на респираторную регуляцию. Количество растворенного в ЦСЖ углекислого газа на 10 мм. рт. ст. выше, чем в плазме и составляет в среднем 50 мм. рт. ст. Перемещение CO2 из плазмы в ЦСЖ происходит за 60 секунд, если же изменение pH плазмы не связано с PaCO2, то для изменений pH ЦСЖ требуется более длительное время. |
Образовавшийся в результате диссоциации угольной кислоты водород активирует хеморецепторы, увеличивая альвеолярную вентиляцию. Так, при повышении PaCO2 в крови на 1 мм. рт. ст. минутный объем дыхания возрастает на 1-4 л/мин сверх нормы.
при развитии алкалоза снижение протонов водорода оказывает депрессивное действие на дыхательный центр. Величина PaCO2 (именно - H+) при которой вентиляция равна нулю, называется порогом апноэ. На практике врачи чаще всего сталкиваются с ним при выходе больного из анестезии, во время которой проводилась гипервентиляция. Отсутствие спонтанных дыхательных попыток больного зачастую принимается за остаточное действие релаксантов либо анестетиков. Гипокапния, обусловленная гипервентиляцией, также препятствует эффективному отучению больных от ИВЛ (weaning).
ПОЧЕЧНАЯ КОМПЕНСАЦИЯ
Почечный механизм компенсации более медленный, чем респираторный. Полноценная почечная компенсация развивается только через несколько дней после изменения pH.
Существует несколько механизмов почечной компенсации:
1. реабсорбция или экскреция бикарбоната;
2. регенерация (образование) бикарбоната;
3. экскреция H+ в виде титруемых кислот и ионов аммония.
Почечная компенсация при ацидозе
При ацидозе механизмы почечной компенсации включаются последовательно и состоят из трех этапов:
· увеличение реабсорбции HCO3-
· увеличение экскреции титруемых кислот
· увеличение выработки аммиака (аммониогенез)
Увеличение реабсорбции HCO3- (см. рис. 2).
В клетках проксимальных почечных канальцев под влиянием Na+/H+-обменника (антипортера) ион натрия поступает из мочи в клетку в обмен на протон водорода. Далее, часть натрия при помощи Na+/K+-АТФазы удаляется в кровь, а протон в моче связывает профильтровавшийся ион бикарбоната и образует молекулу угольной кислоты (Н2СО3). Работа Na+/K+-АТФазы создает концентрационный градиент для ионов натрия между тубулярной жидкостью и клетками проксимальных почечных канальцев. Градиент движения Na+ обеспечивает энергией движение H+ в противоположном направлении.
Угольная кислота под влиянием карбоангидразы IV, которая лежит на поверхности мембраны клеток канальца, распадается на СО2 и Н2О. Далее углекислый газ путем пассивной диффузии и, возможно, через аквапориновые каналы типа 1, поступает в клетки канальца, где за счет работы цитоплазматической фракции карбоангидразы II вновь превращается в угольную кислоту. Угольная кислота подвергается диссоциации до протона и бикарбоната. Протон снова включается в Na+/H+-обмен, а ионы бикарбоната переносятся в кровь. Транспорт HCO3- через базолатеральную мембрану осуществляется при помощи двух механизмов:
1. Na+/HCO3- симпортер (рис. 2);
2. Cl-/HCO3- обменник (рис. 5).
Таким образом возвращаются в кровь 80-85% бикарбоната, оставшиеся 10-20% подвергаются реабсорбции в дистальных канальцах.
Работа протонной помпы проксимальных канальцев сопряжена с реабсорбцией натрия: чем больше натрия реабсорбируется, тем больше выводится протонов водорода, следовательно, увеличивается количество связанного в моче бикарбоната, обеспечивая его возврат в сосудистое русло.
Каждый день почки фильтруют порядка 4320 мэкв бикарбоната (180л/день × 24 мэкв/л), который в обычных условия практически полностью реабсорбируется обратно, сохраняя бикарбонатную буферную систему в целостности. Так как реабсорбция бикарбоната сопряжена с экскрецией водорода, то для полноценной его реабсорбции почкам необходимо секретировать 4320 мэкв водорода в сутки. Дополнительно организму необходимо вывести 80 мэкв водорода, чтобы избавиться от нелетучих кислот, синтезируемых ежедневно. Итого дневная секреция H+ составляет 4400 мэкв/сутки. Практически весь водород секретируется в проксимальных канальцах, и только около 5% H+ секретируются в дистальных канальцах и собирательных трубочках. В проксимальной части нефрона концентрация ионов водорода может быть увеличена только в 3 или 4 раза, тогда как в дистальных отделах количество секретируемого H+ может увеличиваться в 900 раз. Поэтому в проксимальных канальцах pH может быть снижен только до 6,7, а в дистальных анальцах и собирательных трубочках – до 4,5.
Когда практически весь бикарбонат уже реабсорбировался и ионы водорода, которые секретирует Na+/H+-обменник, уже не способны нейтрализоваться бикарбонатом, возникает закисление мочи. Как упоминалось выше, вследствие синтеза нелетучих кислот суточная экскреция водорода превышает фильтрацию бикарбоната на 80 мэкв. Водород способен самостоятельно элиминироваться с мочой в ионизированный форме в виде H+. Таким образом выводиться только небольшое количество H+. Минимальное значение pH мочи составляет 4,5, что соответствует концентрации H+ 10-4.5 мэкв/л или 0,03 мэкв/л. Таким образом, каждый литр мочи может вывести максимум 0,03 мэкв ионизированного (свободного) водорода. Чтобы экскретировать 80 мэкв нелетучих кислот ежедневно почкам необходимо было бы выделить 2667 литров мочи. Буферирование ионов водорода существенно облегчает процессы его элиминации. Наиболее мощными буферными системами мочи являются фосфатная и аммониевая. Существующие другие слабые буферные системы мочи (уратная и цитратная) не играют существенной роли в коррекции pH.

Увеличение экскреции титруемых кислот (буферирование) 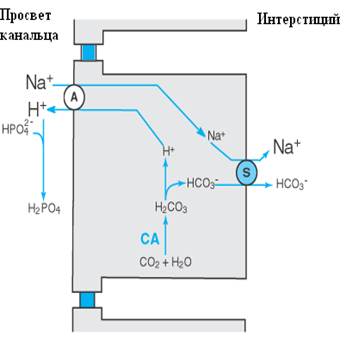
Выведение H+ осуществляется при помощи монофосфата, (HPO42-). В результате образуется H2PO4-, обладающий отрицательным зарядом, препятствующим его канальцевой реабсорбции. H2PO4- существует в моче в виде натриевой соли - NaH2PO4.
В результате работы фосфатного буфера возникает не только титрование ионов водорода, но и сохранение бикарбоната. В этом случае наработанный бикарбонат в клетках почечных канальцах поступает непосредственно в кровь, восполняя его потери во внеклеточной жидкости при ацидозе. Таким образом, если H+ связывается с другими буферами, нежели бикарбонатный, чистым дополнительным эффектом будет являться добавление HCO3- во внеклеточную жидкость.
Фосфатный буфер (H2PO4-/HPO42-) с pK 6,8 является идеальным буфером для мочи. В обычных условиях фосфатный буфер может «связать» только около 30-40 мэкв H+ в день. При нарастании ацидоза и дальнейшем закислении мочи резервы фосфатного буфера исчерпываются, передавая основную роль аммониевой буферной системе.
Увеличение выработки аммиака (аммониогенез)

При истощении запасов монофосфата наиболее важным буфером мочи становится пара аммиак/аммоний - NH3/NH4+. Константа диссоциации для пары аммиак/аммоний равна 9,2, что не совсем подходит для pH канальцевой жидкости. Несмотря на это аммониогенез является спасительным механизмом компенсации возросшей кислотной нагрузки, что объясняется следующим. Аммиак образуется в результате дезаминирования глутаминовой кислоты в митохондриях эпителия почечных канальцев. Эту реакцию ускоряют ацидоз и гипокалиемия.
Одна молекула глутамина метаболизируется до двух молекул аммиака и двух молекул бикарбоната[1]. NH3 легко диф диффундирует через люминальную мембрану, попадает в просвет канальца и взаимодействует с водородом, образуя ион аммония (аммониогенез). NH4+ является ионизированным соединением, не способным проникнуть через клеточную мембрану, свободно элиминируется с мочой в комплексе с ионом хлора. Бикарбонат через базолатеральную мембрану поступает в интерстициальную жидкость и затем в кровь. Чем больше ацидоз, тем больше увеличивается выработка NH3. Таким образом, чистый эффект аммониогенеза заключается не только в выведении ионов водорода, но и в образовании бикарбоната, восполняя его потери во внеклеточной жидкости.
В нормальных условиях количество H+, элиминировавшегося при помощи фосфатного буфера, составляет 50% от всего экскретируемого почками водорода, равно как и количество образованного в почках бикарбоната (в процентном соотношении). Однако при хроническом ацидозе посредством аммониевого буфера почки способны выделять гораздо больше кислот – до 500 мэкв/сутки. Соответственно, увеличивается и образование бикарбоната на 500 мэкв/сутки. Этот механизм играет основную роль в компенсации хронического ацидоза, что будет подробно рассмотрено в главе, посвященной ренальному канальцевому ацидозу. Когда количество ионов водорода во внеклеточной жидкости снижается (алкалоз), почки теряют способность реабсорбировать бикарбонат. Снижение количества бикарбоната вследствие повышенной секреции равносильно расходу его на титрование кислот. Поэтому удаление бикарбоната из организма вызывает увеличение концентрации H+ во внеклеточной жидкости. Чем больше выражен алкалоз, тем больше угнетена реабсорбция НСО3-.
Почки обладают значительными возможностями в коррекции метаболического алкалоза, но также могут являться и непосредственной причиной его развития.
Функциональная роль почечных канальцев такова, что при определённых условиях образование или реабсорбция бикарбоната может резко увеличиваться.
Например, дефицит натрия активирует его реабсорбцию в проксимальных канальцах (см. рис.2). Вследствие увеличения реабсорбции натрия происходит увеличение экскреции водорода (см. рис. 2, работа Na+/H+ антипортера), что в конечном итоге способствует образованию НСО3-. Образование НСО3- в таком случае происходит даже на фоне уже имеющегося метаболического алкалоза Избыток минералокортикоидов может также вызвать метаболический алкалоз. Действуя в дистальных отделах почечных канальцев и в области корковых отделов собирательных трубочек, альдостерон увеличивает реабсорбцию натрия путем облегчения его диффузии через ионные каналы из просвета канальца и повышения активности Na+/K+-АТФазы в базальной мембране (см. рис. 5). Поскольку транспорт натрия не сопряжен с другими ионами, он приводит к перемещению положительного заряда в клетку и наружная цитоплазматическая мембрана приобретает более отрицательный заряд, чем внутренняя, обращенная в сторону кровеносного сосуда(60 мВ против 75 мВ). Компенсировать разность электрохимического потенциала (составляющую на примере около 15 мВ) можно путем увеличения транспорта отрицательно заряженных ионов в интерстиций либо экскрецией положительно заряженных частиц в просвет канальца. В почечных канальцах присутствуют оба механизма – возникающий отрицательный заряд при переносе ионов натрия способствует пассивной диффузии ионов хлора по электрохимическому градиенту через межклеточные соединения и секреции протонов водорода Н+-АТФазой вставочных клеток типа А. Так как секреция Н+ сопряжена с образованием бикарбоната (см. рис.5), то при повышении альдостерон-индуцируемой реабсорбции натрия развивается метаболический алкалоз, причем гиперальдостеронизм (Conn’s syndrome) может являться причиной метаболического алкалоза даже при отсутствии дефицита натрия.
Далее приведем основные причины, влияющие на увеличение или снижение секреции водорода и реабсорбцию бикарбоната (табл. 2).
Таблица 2. Факторы, влияющие на увеличение или снижение секреции H+ и реабсорбции HCO3- в почечных канальцах.
| Увеличение секреции H+ и реабсорбции HCO3- | Снижение секреции H+ и реабсорбции HCO3- |
| ↑ PaCO2 | ↓PaCO2 |
| ↑H+ ↓HCO3- | ↓H+, ↑HCO3- |
| ↓ОЦК | ↑ОЦК |
| ↑Ангиотензин II | ↓Ангиотензин II |
| ↑Альдостерон | ↓Альдостерон |
| Гипокалиемия | Гиперкалиемия |
1 ОСНОВНЫЕ ПОКАЗАТЕЛИ КЩС И ГАЗОВОГО СОСТАВА КРОВИ
pH – показатель кислотности среды, отрицательный десятичный логарифм концентрации ионов водорода, актуальное значение pH артериальной, венозной либо капиллярной крови, определенной без доступа воздуха при температуре 37 ºС, измеряется в единицах;
PaCO2 (partial arterial CO2 pressure) – парциальное давление углекислого газа артериальной, венозной либо капиллярной крови, определённое без доступа воздуха при стандартной температуре 37 ºС, измеряется в мм. рт. ст.;
PaO2 (partial arterial oxygen pressure) - парциальное давление кислорода в газовой среде, уравновешенной с кровью; отражает содержание растворенного в крови кислорода, определяется в мм. рт. ст.;
PAO2 – (partial alveolar oxygen pressure) – парциальное давление кислорода в альвеолярном воздухе; прямо пропорционально концентрации кислорода во вдыхаемой смеси и обратно пропорционально парциальному давлению углекислого газа в артериальной крови; измеряется в мм. рт. ст.
TCO2 (total CO2) - общая концентрация углекислого газа, представляющая собой все формы CO2, находящегося в организме – ионизированная и неионизированная фракции (физически растворённый CO2, ионы бикарбоната, карбоната, карбамата, Н2СО3, а также связанный с белками CO2, в основном в виде карбаминовых соединений), измеряется в ммоль/л;
AB (actual bicarbonate) - истинный (актуальный) бикарбонат плазмы, рассчитывается при реальном (истинном) PaCO2 и истинном насыщении крови кислородом у данного больного, измеряется в ммоль/л. Концентрация актуального бикарбоната изменяется при дыхательных нарушениях КЩС, что позволяет использовать его в качестве показателя компенсации респираторных расстройств;
SB (standard bicarbonate) – стандартный бикарбонат, отражающий концентрацию НСО3- в пробе крови, уравновешенной при 37 ºС со стандартной газовой смесью при PaO2 = 100 мм. рт. ст. и PaCO2 = 40 мм. рт. ст., измеряется в ммоль/л. Так как SB рассчитывается при стандартной газовой смеси, то с помощью его можно оценить тяжесть метаболических расстройств КЩС независимо от дыхательного компонента КЩС у данного конкретного пациента;
BE (base excess) - рассчитанный дефицит либо избыток оснований, т. е. количество сильного основания либо кислоты, необходимое, чтобы вернуть pH к норме при PaCO2 = 40 мм. рт. ст. и температуре 37 ºС. Положительная величина BE свидетельствует о дефиците некарбоновых кислот и о потере ионов водорода, отрицательная величина BE говорит об относительном избытке некарбоновых кислот и приросте ионов водорода, измеряется в ммоль/л;
BE-ecf (base excess - extracellular fluid) – рассчитанный дефицит либо избыток оснований для всей внеклеточной жидкости, включая кровь. Более точный показатель нарушений кислотности, так как в коррекции отклонений КЩС от нормы принимают участие буферные системы не только плазмы, а всей внеклеточной жидкости. Измеряется также в ммоль/л;
BB (base buffers) – концентрация буферных оснований, т. е. сумма ионов бикарбоната и анионов белков, измеряется в ммоль/л;
CaO2 (content arterial oxygen) – общее содержание кислорода в крови, равное сумме физически растворенного и связанного с гемоглобином кислорода, представляет собой теоретическое количество кислорода, способное находится в крови у данного больного (кислородная ёмкость крови), измеряется в мл. O2 на 100 мл. крови (в мг %);
CtO2 (concentration oxygen) – фактическое, действенное содержание кислорода у данного больного, принципиальное отличие от CaO2 заключается в том, что при расчете данного показателя принимается во внимание только переносящие кислород фракции гемоглобина и реальное напряжение кислорода в крови, поэтому CtO2 всегда будет ниже чем CaO2; измеряется также в мл. O2 на 100 мл. крови;
DA-aO2 (difference of alveolar-arterial oxygen) - альвеолярно-артериальная разница по кислороду, отражает объем шунтового кровотока и диффузионную способность лёгких. Альвеолярно-артериальный градиент по кислороду прямо пропорционален объему шунтового кровотока и обратно пропорционален напряжению кислорода в смешанной венозной крови; измеряется в мм. рт. ст.;
SpO2 – отношение оксигенированной
фракции гемоглобина к общей фракции гемоглобина, способной переносить кислород, измеряется в процентах.
Таблица 3. Нормальные значения основных показателей КЩС и ABG
| показатель | Значение |
| pH | 7.35-7.45 |
| PaCO2 | 32-45 мм рт. ст. |
| PaO2 | 80-110 мм рт. ст |
| PAO2 | > 100 мм.рт. ст. |
| TCO2 | 22,7-28,6 ммоль/л |
| AB | 19-25 ммоль/л |
| SB | 20-27 ммоль/л |
| BE | ± 2,5 ммоль/л |
| BE-ecf | ± 2,9 ммоль/л |
| BB | 40-60 ммоль/л |
| P50 | 24-28 мм.рт. ст. |
| CaO2 | 18,8-22,3 мг% |
| CtO2 | 18,8-22,3 мг% |
| DA-aO2 | 5-15 мм рт. ст. |
| SpO2 | 95-99% |
ОЦЕНКА ОТКЛОНЕНИЙ КЩС
Первичные метаболические расстройства
Первичные метаболические расстройства могут иметь место, если
· pH и CO2 изменены в одном направлении;
· pH изменено, а CO2 – нет.
При установлении метаболических нарушений рассчитываются сопутствующие компенсаторные дыхательные отклонения
отклонения:
· для метаболического ацидоза:
Предполагаемое
PaСО2 = 1,5 × (НСОз-) + 8(±2)
· для метаболического алкалоза:
Предполагаемое
PaСО2 = 0,7 × (НСОз-) + 20(±1,5)
Если действительное PaCO2 у больного выше предполагаемого, то метаболическое нарушение дополнительно ассоциируется с респираторным ацидозом, если же измеренное PaCO2 ниже предполагаемого, то это свидетельствует о наличии скрытого респираторного алкалоза.
Первичные респираторные расстройства
Первичные респираторные нарушения регистрируются если:
· pH и PaCO2 изменены в противоположных направлениях
Сопутствующие компенсаторные метаболические нарушения рассчитываются следующим образом:
респираторный ацидоз
при наличии острого респираторного ацидоза наблюдается уменьшение рН на 0,008 при повышении PaCO2 на 1 мм рт. ст.:
pH = 7,40 – [0,008 × (PaCO2 – 40)]
· при наличии хронического респираторного ацидоза уменьшение pH на 0,003 соответствует изменению PaCO2 на 1 мм рт. ст.:
pH = 7,40 – [0,003 × (PaCO2 – 40)]
респираторный алкалоз
· при наличии острого респираторного алкалоза наблюдается увеличение рН на 0,008 при снижении PaCO2 на 1 мм рт. ст.:
pH = 7,40 + [0,008 × (40 - PaCO2)]
· при наличии хронического
|
|
|


