 |
Образовательные технологии
|
|
|
|
Для формирования мотивационной готовности студентов к инновационной деятельности наряду с традиционными образовательными формами (лекции, семинарские и лабораторные занятия, контрольные работы и коллоквиумы) используются современные технологии и активные методы обучения:
· современные системы электронной поддержки процесса обучения, в частности, интерактивные компьютерные технологии при чтении лекций, обеспечивают эффективные и комфортные условия для обучающихся и преподавателей;
· выполнение теоретических индивидуальных заданий, предполагающих сбор материала по теме, его анализ и переработку с целью составления конспекта и устного сообщения формирует умение работы с литературой, культуру делового сообщения и ведения дискуссий;
· применение электронных ресурсов (сети Интернет) при выполнении творческой работы по написанию конспекта;
· использование активных и интерактивных методов обучения (семинары в режиме консультации, тестовый экспресс-контроль, защита результатов практической работы в форме конференции и др.);
6. ОЦЕНОЧНЫЕ СРЕДСТВА ДЛЯ ТЕКУЩЕГО КОНТРОЛЯ УСПЕВАЕМОСТИ, ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ ПО ИТОГАМ ОСВОЕНИЯ ДИСЦИПЛИНЫ И УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
Примеры индивидуальных заданий по теме «Энергетика химических реакций».
Вариант 1
1. Написать термохимическое уравнение реакции растворения оксида меди(II) в соляной кислоте. Сколько тепла выделяется при растворении 100 г оксида?
2. Определить энтальпию образования пентафторида мышьяка на основе данных:
2As(к) + 3F2(г) = 2AsF3(г), ΔН°1 = -1842 кДж
AsF5(г) = AsF3(г) + F2(г), ΔН°2 = 317 кДж.
3. Рассчитать значение ΔGO298 следующих реакций и установить, в каком направлении они могут протекать самопроизвольно при 25°С:
|
|
|
l. NiО (к) + Pb(к) = Ni(к) + PbО(к)
2. 8А1 (к) + 3Fe3O4(к) = 9Fe (к) + 4А12О3 (к)
Вариант 2
1. Определить тепловой эффект реакции:
2Mg(к) + СО2(г) = 2MgО(к) + С(графит)
Рассчитать, сколько теплоты выделяется при сгорании 1 кг магния по этой реакции.
2. Рассчитать теплоту образования мышьяковой кислоты на основе данных:
Н2(г)+1/2О2(г) = Н2О(ж), ΔН°1 = -285,85 кДж
2As(к) + 3/2O2(г) = As2O3(к), ΔН°2 = -653,98 кДж
As2O3(к) + 3H2O(к) = 2H3AsO4(к), ΔН°3 = 31,61 кДж
3. Вычислить значение ΔGO298 следующих реакций и сделать вывод о том, протекание какой из них более вероятно:
1. FeO(к) + 1/2С(графит) → Fe(к) + 1/2СО2(г)
2. FeO(к) + CO(г) → Fe(к) + CO2(к)
Вариант 3
1. Чему равно изменение энтальпии реакции разложения бертолетовой соли:
KClO3 → KCl + 3/2O2
Сколько теплоты выделяется (поглощается) при разложении одного килограмма KClO3 по этой реакции?
2. Записать термохимическое уравнение реакции разложения гидроксида алюминия на оксиды и вычислить тепловой эффект этой реакции при 298 К.
3. Определить направление самопроизвольного протекания реакций в стандартных условиях (система неизолированная):
1. N2O(г) + NO2(г) = 3NO(г)
2. СН4(г) + 3СО2(г) = 4СО(г) + 2Н2О(г)
Примеры индивидуальных заданий по теме «Кинетика химических реакций»
Вариант 1
1. Во сколько раз изменится скорость прямой реакции в системе:
СаО(к) + СО2(г) ↔ СаСО3(к) , если:
а) в 5 раз увеличить концентрацию СаО?
б) уменьшить давление в 2 раза?
2. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость её увеличилась в 2 раза?
3. После достижения равновесия в системе:
N2(г) + 3H2(г) ↔ 2NH3(г)
равновесные концентрации веществ, участвующих в реакции, составили (моль/л): [N2]р=1; [Н2]р=6; [NH3]р=2. Определить константу равновесия и исходные концентрации азота и водорода.
Вариант 2
1. Какая из реакций является гетерогенной? Записать кинетические уравнения для обеих реакций:
|
|
|
a)N2(г) + О2(г) ↔ 2NO(г),
б) СаСО3(г) ↔ СаО (к) + СО2(г).
2. Как изменится скорость реакции при увеличении температуры от –10 до +40°С, если температурный коэффициент скорости равен 2?
3. Написать выражение для констант равновесия следующих реакций:
a) FeO(к)+CO(г) ↔ Fe(к) + CO2(г) ,
6) 2NO2(г) ↔ 2NО(г) + О2(г).
Вариант 3
1. Во сколько раз изменится скорость необратимой реакции
А(г) + В(г) → С(г), если:
а) давление изменяется за счёт сжатия системы в 5 раз?
б) концентрация вещества В уменьшается в 5 раз?
2. Во сколько раз увеличивается скорость реакции, если температура возрастает от 50 до 70°С, а температурный коэффициент равен 3?
3. Как повлияет на равновесие приведенных ниже реакций увеличение а) температуры и б) давления?
l) N2(г) + 3H2(г) ↔ 2NH3(г), H0p = –92 кДж,
2) С(к)+СО2(г) ↔ 2СО(г), Н0р = 170 кДж.
Примеры индивидуальных заданий по теме «Растворы»
Вариант 1
1. Сколько литров СО2 (н.у.) выделится при действии избытка НС1 на 500 мл 2 н раствора Na2СО3?
2. Определить массовую долю Мg(NО3)2 в растворе, полученном смешиванием 300 г 10% и 500 г 2% растворов Mg(NО3)2.
3. Раствор 9,2 г йода в 100 г метанола закипает при 65°С, а чистый метанол кипит при 64,7°С (Е метанола = 0,84). Из скольких атомов состоит молекула йода в растворе метанола?
Вариант 2
1. Какой объём 25% раствора H2SO4 (ρ = 1,1 г/мл) потребуется для реакции с 25 г магния?
2. В лаборатории имеются растворы с массовой долей NaCl 10% и 20%. Какую массу каждого раствора надо взять для получения раствора с массовой долей соли 12% массой 300 г?
3. Водно-спиртовый раствор, содержащий 20%спирта (ρ = 0,97 г/мл), замерзает при –10,26°С. Найти молекулярную массу спирта ( =1,86).
=1,86).
Вариант 3
1. Для нейтрализации 50 мл 0,1 н раствора КОН потребовалось 15 мл кислоты. Определить молярную концентрацию эквивалента (нормальность) кислоты и титр КОН.
2. К 300 мл 30% раствора серной кислоты с плотностью 1,22 г/см3 добавили 1 л воды. Рассчитайте процентную концентрацию полученного раствора и титр 30% раствора кислоты.
3. При некоторой температуре давление пара над раствором, содержащим 31 г анилина C6H5NН2 в 30 моль эфира, равно 72,09 кПа. Вычислить давление эфира при этой же температуре.
|
|
|
Примеры вариантов контрольной работы
Вариант № 1
1. Рассчитать Св, См, С экв(f) 20% раствора серной кислоты с r = 1,155 г/мл.
2. Рассчитать осмотическое давление и давление насыщенного пара водного раствора, содержащего 50 г глицерина в 300 г воды при 60°С, если плотность равна 1,05 г/мл, а давление насыщенного пара воды 19,92 кПа.
3. Рассчитать рН 0,028 М раствора СН3СООН (КК = 1,8×10-5) и 0,05М раствора НСN (КК = 7,9×10-10).
4. Вычислить DН° реакции:
Fe2O3(к) + 3Н2(г) ® 2 Feк + 3Н2О(г),
пользуясь табличными данными.
Вариант № 2
1. Сколько мл 5,5% серной кислоты с r = 1,035 г/мл можно приготовить из 50 мл 35% раствора с плотностью 1,26г/мл.
2. Вычислить молярную массу соединения, если раствор 6,15г вещества в 400г бензола кристаллизуется при 4,86°С, температура кристаллизации бензола 5,5°С, а криоскопическая постоянная 5,12. Предложите формулу соединения.
3. Рассчитать рН 0,05 М раствора СН3СООН (КК=1,8×10-5). Как изменится рН при добавлении в раствор 0,035М СН3СООNa с a = 80%.
4. Константа равновесия процесса
2NO(г) + О2 ¾¾®2NO2(г)
составляет 1,1. Равновесные концентрации [NO]=0,01моль/л, [NO2]=0,015 моль/л. Рассчитать исходную концентрацию кислорода.
Вариант № 3
1. Рассчитать массовую долю насыщенного при 410С раствора нитрата калия, если коэффициент растворимости составляет 63,9. Рассчитать массу осадка при охлаждении 100г насыщенного раствора KNO3 до 20°С, если коэффициент растворимости при 20°С 31,6.
2. Вычислить давление насыщенного пара 10% раствора Ba(NO3) при 280С, если давление насыщенного пара воды при 28°С 3779Па, кажущаяся степень диссоциации 0,575. При какой температуре замерзает этот раствор.
3. Рассчитать рН 0,017М раствора NH4OH (КО = 1,8 . 10-5). Как изменится рН при добавлении 0,034 М хлорида аммония.
4. Рассчитать константу равновесия образования ацетона при 400К, если при 298К lgКрравен 2,13, а тепловой эффект 24688 Дж/моль.
Вариант № 4
1. Рассчитать СВ, СМ, Сэкв(f), c 11% раствора серной кислоты с r = 1,07 г/мл.
2. Вычислить кажущуюся степень диссоциации нитрата кальция, если раствор 16,72 г соли в 250г воды имеет давление насыщенного пара 1903 Па, а давление насыщенного пара воды в этих условиях 1937 Па.
|
|
|
3. Рассчитать рН 0,0027 М раствора угольной кислоты (КК = 4,52×10-7), как изменится рН при добавлении 0,0035М гидрокарбоната калия.
4. Рассчитайте  0 процесса
0 процесса
СН4(г) + СО2(г) ® 2 СО(г) + 2Н2(г)
по табличным данным стандартных энтальпий образования.
Вариант № 5
1. Рассчитайте массовую долю и молярную концентрацию насыщенного при 20°С раствора KNO3 c коэффициентом растворимости 31,6 и r = 1,16 г/мл.
2. Давление насыщенного пара 4% раствора KCl и давления пара воды составляют соответственно 2297 и 2338 Па. Вычислить осмотическое давление этого раствора при 200С, если r = 1,026 г/мл.
3. Рассчитать рН 0,0071 М растворов H2SO4 и KOH.
4.Определить стандартное изменение энтальпии (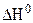 ) реакции горения метана:
) реакции горения метана:
СН4(г) + СО2(г) ® 2СО(г) + 2Н2О(г),
зная энтальпии образования.
По каждой теме составлены индивидуальные задания (25 вариантов), включающих 4 контрольных вопроса.
Вопросы текущего контроля знаний студентов
· Показать механизм свободнорадикального замещения на примере реакции хлорирования изобутана:
· Показать электронные эффекты и определить направление атаки электрофила в молекуле бензойной кислоты:
· Осуществить конформационный анализ молекулы CH3-CH2-CH2-OH. Назвать конформации.
· Показать механизм свободнорадикального замещения на примере реакции бромирования этана:
· Показать электронные эффекты и определить направление атаки нуклеофила в молекуле уксусной кислоты:
· Написать формулы Фишера, назвать энантиомеры валина по D-,L- и R-,S-номенклатуре:
· Показать механизм электрофильного присоединения на примере реакции гидробромирования бутена-1:
· Написать формулы Фишера, назвать энантиомеры молочной кислоты по D-,L- и R-,S-номенклатуре:
· Показать механизм электрофильного присоединения на примере реакции гидратации пропена в условиях кислотного катализа
· Показать электронные эффекты и определить направление атаки нуклеофила в молекуле пиридина:
· Осуществить конформационный анализ молекулы Cl-CH2-CH2-Br. Назвать конформации.
· Напишите уравнения реакций к следующей схеме превращений:
· 
· Напишите уравнения реакций: а) взаимодействия аланина с гидроксидом калия (с образованием соли); б) взаимодействия валина со свежеосажденным Cu(OH)2 с образованием комплексного соединения; в) взаимодействия лейцина с этиловым спиртом (этерификация).
· В схеме превращений, приведенной ниже, расшифруйте вещества A – D. Напишите уравнения соответствующих реакций.

· Напишите уравнения реакций: а) декарбоксилирования лизина в щелочной среде; б) взаимодействия валинас формальдегидом; в) неокислительного дезаминирования аспарагиновой кислоты с образованием непредельной кислоты; г) переаминирования (трансаминирования) фенилаланина при его взаимодействии с пировиноградной кислотой.
|
|
|
· Напишите уравнения реакций к следующей схеме превращений:
a., 
• На основе строения аминокислот аланина фенилаланина и валина предскажите, какой изоэлектрической точкой они будут обладать (р I =7,0, р I >7,0 или р I <7,0). Рассчитайте для них величины изоэлектрических точек (см. таблицу А.5 приложения).
• При отравлении солями ртути(II) человеку дают выпить яичный белок. Чем это можно объяснить? Какой белок будет более эффективен в этом случае – яичный альбумин (р I 4,8) или казеин молока (р I 4,6)? Напишите схему взаимодействия белка с солями ртути(II).
• Рассчитайте, сколько пептидов может быть получено: а) из девяти разных аминокислот; б) из восьми аминокислот, две из которых одинаковые; в) из десяти аминокислот, две из которых одинаковые.
• Какие из пептидов, приведенных ниже, будут давать положительную реакцию Фоля (сульфгидрильную реакцию)? Свой ответ обоснуйте. Приведите уравнение реакции Фоля, написав его с необходимой аминокислотой. а) NH2–Ala–Cys–Phe–Cys–СООН; б) NH2–Gly–Val–Gly–Ser–Ala–СООН; в) NH2–Ser–Ala–Met–Pro–СООН; г) NH2–Gly–Cys–Cys–Ala–Ala–СООН.
• Все ли белки дают: а) биуретовую реакцию; б) ксантопротеиновую реакцию; в) сульфгидрильную реакцию (реакцию Фоля)? Объясните свой ответ.
• Какие трипептиды можно получить из смеси аминокислот Gly, Ala и Val? Напишите схемы реакций их получения (аминокислоты изобразите трехбуквенно; в трипептидах укажите N - и С -концы).
• Охарактеризуйте строение и биологическую роль гемоглобина.
• Охарактеризуйте строение и биологическую роль зрительного родопсина.
• Охарактеризуйте строение и биологическую роль миоглобина.
• При попадании в кровь цианидов, например, цианида калия, происходит их взаимодействие с гемоглобином крови, в результате чего последний не может транспортировать кислород. Объясните, почему это происходит. Напишите реакцию дезактивации гемоглобина, используя для этого следующую условную формулу дезоксигемоглобина (дезоксиHb):
• Гемоглобин, взаимодействуя с угарным газом, не может переносить кислород к клеткам организма. Объясните причину этого процесса, записав схему взаимодействия с использованием формулы из предыдущей задачи.
• Напишите уравнения реакций взаимодействия дисахарида мальтозы со следующими веществами: а) бромной водой; б) избытком бромметана. Составьте уравнение гидролиза мальтозы. Дает ли мальтоза положительную пробу Троммера? Свой ответ обоснуйте.
• Напишите схему цикло - оксо -таутомерии для D -галактозы.
• Расшифруйте вещества А – D, назовите их и напишите уравнения соответствующих реакций:

• Напишите уравнения реакций взаимодействия дисахарида лактозы со следующими веществами: а) бромной водой; б) избытком йодметана; в) избытком уксусного ангидрида. Реагирует ли лактоза с реактивом Толленса? Свой ответ обоснуйте.
Вопросы текущего контроля знаний студентов по разделу «Строение атома. Перио- дический закон Д.И.Менделеева. Периодическая система элементов. Химическая связь».
1. Теория Бора, Резерфорда, Томсона.
2. Уравнение Луи де Бройля, Принцип неопределенности Гейзенберга. Понятие атомной орбитали. Корпускулярно-волновой дуализм.
3. Строение многоэлектронных атомов. Принцип Паули. Правило Гунда.
4. Правила Клечковского. Примеры.
5. Современная квантово-механическая модель атома Уравнение Шредингера.
6. Квантовые числа.
7. Гибридизация атомных орбиталей.
8. Периодическая система Д.И.Менделеева. Периодический закон. Структура Периодической системы.
9. Понятие химической связи. Основные типы и характеристики химической связи.
10. Ковалентная неполярная связь.
11. Периодическое изменение свойств элементов. Энергия ионизации, сродства к электрону, электроотрицательность, их изменения в группах и периодах.
12. Основные виды взаимодействия молекул. Силы межмолекулярного взаимодействия. Водородная связь.
13. Ионная связь. Основные свойства ионной связи.
14. Метод молекулярных орбиталей.
15. Метод валентных связей.
16. Ковалентная полярная связь.
17. Свойства ковалентной связи.
Примерные вопросы к экзамену
1. Периодический закон Д.И. Менделеева.
2. Теория строения атома Томсона, Резерфорда.
3. Теория строения атома Бора.
4. Принцип Гейзенберга.
5. Квантовомеханическая модель атома.
6. Квантовые числа.
7. Правила Клечковского.
8. Основные характеристики атома.
9. Электронная структура атома.
10. Электронная структура атома. Принцип Паули.
11. Графическое изображение состояния электронов в атоме. Правило Гунда.
12. Законы термохимии.
13. Первый закон термодинамики.
14. Второй закон термодинамики.
15. Третий закон термодинамики.
16. Термодинамические функции.
17. Понятие энтропии. Направленность химических реакций.
18. Основы теории молекулярных орбиталей и теории направленных валентностей.
19. Ковалентная связь. Свойства ковалентной связи.
20. Ионная связь.
21. Неспецифические виды связи.
22. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия.
23. Смещение химического равновесия. Принцип Ле-Шателье.
24. Электролиты. Теория диссоциации слабых электролитов.
25. Сильные электролиты. Теория сильных электролитов.
26. Закон разбавления Оствальда.
27. Классы неорганических соединений.
28. Законы неэлектролитов. Закон распределения. Закон Генри. Явление осмоса.
29. Основные понятия растворов
30. Гидролиз соли по катиону.
31. Основные понятия растворов.
32. Законы неэлектролитов. Законы Вант-Гоффа, Рауля.
33. Зависимость скорости реакции от концентрации, температуры и природы вещества, присутствия катализаторов.
34. Характеристики процесса гидролиза.
35. Полные и сокращенные ионно-молекулярные уравнения.
36. Зависимость процесса гидролиза от различных факторов.
37. Способы выражения концентраций.
38. Работа гальванического элемента. Уравнение Нернста.
39. Электролиз расплавов и растворов. Законы электролиза.
40. Оксиды углерода. Угольная кислота и ее соли. Карбонаты и бикарбонаты, их растворимость и гидролиз. Соединения углерода с галогенами, серой, азотом.
41. Оксиды азота, строение, получение и химические свойства. Кислородсодержащие кислоты азота и их соли. Применение азота и его соединений.
42. Кислотно-основные свойства оксидов и кислот элементов подгруппы хлора в зависимости от степени окисления элементов. Влияние среды на окислительную активность соединений хлора.
43. Биологическая роль элементов 1 группы периодической системы Д.И. Менделеева. Общая характеристика.
44. Биологическая роль элементов 11 группы периодической системы Д.И. Менделеева. Общая характеристика.
45. Биологическая роль элементов 111 группы периодической системы Д.И. Менделеева. Общая характеристика.
46. Биологическая роль элементов 1У группы периодической системы Д.И. Менделеева. Общая характеристика.
47. Биологическая роль элементов У группы периодической системы Д.И. Менделеева. Общая характеристика.
48. Биологическая роль элементов У1 группы периодической системы Д.И. Менделеева. Общая характеристика.
49. Биологическая роль элементов У11 группы периодической системы Д.И. Менделеева. Общая характеристика.
50. Соединения бора с галогенами. Борофтористоводородная кислота.
51. Фосфорные кислоты, их соли. Получение, свойства.
52. Серные кислоты, их соли. Получение, свойства.
53. Аллотропные модификации свободного углерода. Химические свойства углерода.
54. Оксиды азота. Строение, свойства, получение. Азотная, азотистая кислоты, их соли.
55. Оксид кремния (IV), его полиморфные модификации, свойства.
56. Классификация органических соединений. Функциональные группы и органические радикалы.
57. Основные правила систематической номенклатуры ИЮПАК для органических соединений. Заместительная и радикально-функциональная номенклатура.
58. Основы номенклатуры алифатических, алициклических углеводородов и их полифунк- циональных производных.
59. Классификация, основы номенклатуры важнейших представителей ароматических углеводородов, гетероциклических соединений и их полифункциональных производных. Классификация и номенклатура жизненно важных и биологически активных соединений. Взаимное влияние атомов в молекулах органических соединений и способы его передачи. Поляризация связей и электронные эффекты (индуктивный и мезомерный). Пространственные эффекты.
60. Виды сопряжения. Сопряженные системы с открытой и замкнутой цепью. Ароматич- ность и ее критерии. Правило Хюккеля. Ароматичность бензоидных и гетероцикли- ческих соединений.
61. Классификация органических реакций. Классификация органических реакций по механизму и конечному результату. Гомолитический и гетеролитический разрыв ковалентных связей. Электронное и пространственное строение образующихся интермедиатов. Электронодонорные и электроноакцепторные заместители.
62. Реакции электрофильного присоединения. Реакции электрофильного присоединения с участием ненасыщеных субстратов на примерах гидратации и гидрогалогенирования Региоселективность реакций. Правило Марковникова. Особенности электрофильного присоединения к сопряженным системам.
63. Реакции электрофильного замещения. Электронная структура и реакционная способность ароматических соединений. Реакции электрофильного замещения и их механизмы. Влияние заместителей в ароматическом ядре и гетероатомов в гетероцик- лических соединениях на реакционную способность в реакциях электрофильного замещения. Ориентирующее влияние заместителей и гетероатомов.
64. Кислотно-основные свойства органических соединений. Кислотность и основность органических соединений. Теории Бренстеда и Льюиса. Общие закономерности изменения кислотных и основных свойств в зависимости от природы атома в кислот- ном и основном центрах, электронных эффектов заместителей и сольватационных эффектов. Кислотные свойства протонсодержащих функциональных групп. Основные свойства нейтральных молекул, имеющих гетероатом с неподеленной электронной парой.
65. Стереоизомерия органических молекул. Пространственное строение органических соединений. Конформация и конфигурация молекул. Конформации открытых цепей. Конформации циклических соединений. Конфигурация. Проекционные формулы Фишера. Общие принципы стереохимической номенклатуры. Оптическая активность. Причины хиральности органических соединений. Виды стереоизомеров.  –Диастерео- меры.
–Диастерео- меры.
66. Проблема взаимосвязи стереохимического строения с проявлением биологической активности.
67. Реакции нуклеофильного замещения у насыщенного атома углерода. Влияние электронных, пространственных факторов и стабильности уходящих групп на реакционную способность соединений. Стереохимия реакций нуклеофильного замещения. Биологическая роль реакций алкилирования.
68. Реакции элиминирования. Реакции элиминирования на примерах дегидрогалогени- рования и дегидратации.
69. Реакции нуклеофильного присоединения с участием карбонильной группы. Реакции карбонильных соединений с водой, спиртами, тиолами, аминами. Влияние электрон- ных и пространственных факторов, роль кислотного катализа. Биологическое значение этих процессов.
70. Реакции нуклеофильного замещения у sp2 – гибридизованного атома углерода. Реакции нуклеофильного замещения карбоновых кислот и их функциональных производных на примерах образования и гидролиза ангидридов, сложных эфиров и тиоэфиров, амидов.
71. Окисление и восстановление органических соединений. Реакции окисления спиртов, тиолов, сульфидов, карбонильных соединений, аминов. Реакции восстановления карбонильных соединений, дисульфидов, иминов. Понятие о переносе гидрид-иона и химической основе действия системы НАД+ - НАДН. Понятие об одноэлектронном переносе и химической основе действия ФАД-ФАДН2.
72. Строение, химические свойства и реакционная способность поли- и гетерофунк- циональных соединений. Циклизация и хелатообразование. Особенности во взаимном влиянии функциональных групп в зависимости от их относительного расположения. Таутомерные превращения. Многоатомные спирты. Двухатомные фенолы. Система гидрохинон-хинон как химическая основа убихинонов в окислительно-восстановительных процессах. Фенолы и антиоксиданты.
73. Двухосновные карбоновые кислоты. Аминоспирты: холин, ацетилхолин. Аминофенолы: дофамин, норадреналин, адреналин. Одноосновные (молочная β- и γ-гидроксимасляные), двухосновные (яблочная, винные), трехосновные (лимонная) гидроксикислоты. Альдегидо- и кетонокислоты.
74. Гетерофункциональные производные бензольного ряда как лекарственные средства. Салициловая кислота и ее производные. п -Аминобензойная кислота и ее производные. Сульфаниламидные препараты.
75. Химия биологически активных гетероциклических соединений и лекарственных препаратов. Гетероциклы с одним гетероатомом. Пиррол, индол, пиридин, хинолин. Понятие о строении тетрапиррольных соединений (порфирин, гем). Биологически важные производные пиридина. Производные 8-гидроксихинолина – антибактери- альные средства комплексообразующего действия. Гетероциклы с несколькими гете-роатомами. Пиразол, имидазол тиазол, пиразин, пиримидин, пурин. Барбитуровая кислота и ее производные. Гидроксипурины.
76. Алкалоиды. Представление о строении и медико-биологическом значении никоморфина, хинина, атропина, теобромина, кофеина.
77. Моносахариды. Строение и классификация. Стереоизомерия и цикло-оксо-таутомерия моносахаридов на примере пентоз, гексоз и аминосахаров. Формулы Фишера и Хеуорса. Конформация пиранозных форм моносахаридов. Наиболее важные предста- вители пентоз, гексоз, дезоксисахаров, аминосахаров. Нуклеофильное замещение у аномерного центра на примере образования О- и N-гликозидов. Фосфаты моносаха- ридов. Окисление и восстановление моносахаридов. Взаимопревращение альдоз и кетоз. Реакции альдольного типа в ряду моносахаридов.
78. Полисахариды. Олигосахариды. Дисахариды. Особенности в химическом строении восстанавливающих и невосстанавливающих дисахаридов. Гомополисахариды: крахмал, гликоген, декстран, целлюлоза. Пектины. Первичная структура, гидролиз. Понятие о вторичной структуре (амилоза, целлюлоза). Гетерополисахариды: гиалуроновая кислота, хондритинсульфаты. Строение и медико-биологическое значение гепарина.
79. Аминокислоты. Пептиды и белки. Протеиногенные аминокислоты. Строение. Стереоизомерия. Кислотно-основные свойства. Биосинтетические пути образования из оксокислот. Реакции восстановительного аминирования и трансаминирования. Пиридоксалевый катализ. Химические свойства α-аминокислот. Биологически важные реакции α-аминокислот. Реакции дезаминирования, гидроксилирования и декарбоксилирования. Пептиды. Строение пептидной группы. Гидролиз пептидов. Белки. Понятие о первичной и вторичной структурах. Сложные белки.
80. Нуклеиновые кислоты. Пиримидиновые и пуриновые основания. Лактим-лактамная таутомерия. Реакции дезаминирования. Нуклеозиды, гидролиз. Нуклеотиды, строение. Гидролиз нуклеотидов. Первичная структура нуклеиновых кислот. Строение и функции ДНК и РНК. Понятие о вторичной структуре ДНК. Лекарственные средства на основе модифицированных нуклеиновых оснований (фторурацил, меркаптопурин).
81. Омыляемые липиды. Омыляемые липиды. Жиры. Масла. Природные высшие жирные кислоты. Пероксидное окисление фрагментов жирных кислот в клеточных мембранах. Фосфолипиды – как структурные компоненты клеточных мембран. Сфинголипиды. Гликолипиды. Перекисное окисление липидсодержащих систем. Представление об антиоксидантной защите.
82. Неомыляемые липиды. Стероиды. Стероиды. Конформационное строение, биологическая роль. Углеводороды – родоначальники групп стероидов: эстран, андростан, прегнан, холан, холестан. Стероидные гормоны. Желчные кислоты. Стерины. Холестерин и эргостерин. Агликоны сердечных гликозидов: дигитокси- генин, строфантидин. Характеристика основных групп стероидов.
83. Терпеноиды. Моно- и бициклические терпены. Лимонен, ментол, камфора. Сопряженные полиены: каротиноиды, витамин А.
|
|
|


