 |
Перемножив все эти равенства, получим
|
|
|
|
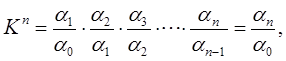
Откуда
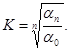 (24)
(24)
Частично упругий удар сопровождается, как известно, диссипацией (рассеянием) энергии: часть механической энергии переходит в другие вида энергии - энергию остаточной деформации и внутреннюю (тепловую) энергию. Энергию диссипации Еg одного шара, относящуюся к одному соударению, можно выразить через коэффициент восстановления К. Для этого запишем закон сохранения энергии для, частично упругого удара двух одинаковых шаров:

Учитывая, что 
получим
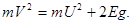
Откуда
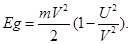
Учитывая (18), (21), имеем
 (25)
(25)
Описание лабораторной установки
На лабораторной установке (рис. 3) два стальных шара расположены на бифилярных подвесах, что обеспечивает их взаимодействие в одной плоскости. Шары удерживаются в отклоненном положении двумя электромагнитами (ЭМ), обмотки которых подключаются к источнику питания одним выключателем. Электромагниту могут перемещаться, их положение фиксируется винтами. Углы отклонения шаров от положения равновесия отсчитываются по шкалам Ш в градусах. При отключении питания электромагнитов шары начинают двигаться друг к другу под действием силы тяжести.
Порядок выполнения работы
1. Установить электромагниты так, чтобы шары были отклонены на одинаковый угол α0. Включить питание электромагнитов и отклонить шары так, чтобы они удерживались электромагнитами при натянутой нити. Измерить длину нити l.
2. Выключателем отключить питание электромагнитов и определить угол отклонения α n после нескольких соударений (n = 2 – 5). Записать в таблицу измерений угол α n отклонения шаров после последнего соударения и число соударений. Повторить опыт четыре раза и найти среднее значение α n.
|
|
|
3. Проделать операции, указанные в пп. 1, 2 пять раз для разных значений начальных углов отклонения α0. Данные занести в таблицу.
4. Рассчитать по формуле (24) коэффициенты восстановления скорости К для всех заданных начальных углов отклонения. Найти среднее значение К и погрешности метода его измерения.
5. Для всех значений начального угла отклонения, при которых определялся К, посчитать энергию диссипации по формуле (25). Найти погрешности.
6. Рассчитать скорость V шара в момент удара при всех значениях начального угла α0 по формуле (21).
7. По полученным данным, построить зависимость Еg (V).
Контрольные вопросы и задания
1. Что называется коэффициентом восстановления относительной скорости при ударе? Как он определяется в данной работе и от чего зависит?
2. Какие законы динамики выполняются при абсолютно упругом и неупругом ударах?
3. Что называется энергией диссипации?
4. Получите соотношение для определения энергии диссипации.
4. ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ КЛЕМАНА И ДЕЗОРМА
Цель работы
Определить экспериментально отношение молярных теплоемкостей газа при постоянном давлении и постоянном объеме и сравнить с теоретическим значением данного отношения, найденным из молекулярно-кинетической теории.
Приборы и принадлежности
Баллон с краном, водяной манометр, компрессор.
Теоретическое введение и описание лабораторной установки
На лабораторной установке (рис. 4) баллон 1 соединен с открытым V -образным водяным манометром 2. Рычажной край 3 через впускной-выпускной штуцер 4 позволяет сообщаться баллону через резиновую трубку 6 с нагнетающим насосом 5 или с атмосферой. В сосуд накачивают воздух до максимально допустимого давления. Через 2-3 мин температура воздуха в сосуде становится равной температуре окружающей среды. Обозначим для первого данного состояния газа его удельный объем V1, давление P1, температуру Т1.
|
|
|
Далее, отсоединив трубку 6 от штуцера 4, быстро нажмем и отпустим рычаг клапана, на мгновение, соединив баллон с окружающим воздухом. Практически сразу давление воздуха в баллоне станет равным атмосферному. Процесс происходит быстро и его можно считать адиабатическим. Новый удельный объем воздуха - V2, давление - P2=P0 (атмосферное) и температура - Т2. Через 2-3 мин воздух в баллоне нагреется до комнатной температуры T3 = Т1, его давление будет P3, а удельный объем V3=V2 (ни масса, ни объем газа не меняются).
Переход из первого, состояния во второе (адиабатический процесс) описывается уравнением Пуассона
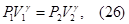
где 

Сравнивая конечное, третье состояние газа с первым, видим, что температура газа в этих состояниях одинакова, следовательно, к этому переходу применим закон Бойля-Мариотта
P1V1=P2V2, (27)
Решая систему двух уравнений ((26), (27)), можно определить γ. Для этого возведем второе уравнение в степень γ разделим его на первое уравнение:

Так как V2=V3, то 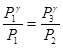 или
или 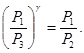
Логарифмируя последнее выражение, получим


Обозначим разность уровней жидкости в манометре в первом состоянии h1, а в третьем состоянии - h3. Тогда
P1=P0+h1, P3=P0+h3, (P2=P0)
Подставим значения Р1, Р2, Р3 в соотношение (28):

В данном случае h1 и h3 намного меньше Р0, поэтому отношение разности логарифмов можно заменить отношением разности чисел, т.е.
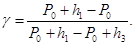
Это дает расчетную формулу для нашего опыта
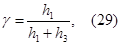
В молекулярно-кинетической теории молярные теплоемкости газа Сp и Сv определяются через число степеней свобода молекулы i и универсальную газовую постоянную R:
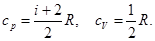
Найдем их отношение

В данном случае воздух не очищается от влаги и содержит большое количество паров воды, поэтому число степеней свободы будет соответствовать трехатомным молекулам, т.е. i = 6.
Порядок выполнения работы
1. Вставить резиновую трубку 6 насоса в штуцер 4. Включить насос. Нажать и удерживать в нажатом положений рычаг клапана 3. Наблюдая по шкале манометра 2 за увеличением давления в баллоне 1, довести давление до показания уровня воды в левой трубке манометра примерно 20 см. Отпустить рычаг клапана.
|
|
|
2. Подождать 2-3 мин, пока температура в баллоне не уравняется с температурой окружающего воздуха. Определить давление газа в баллоне по формуле h1=hл-hn, где hл и hn - высота уровня воды в левой и правой трубках манометра, соответственно. hл и hn, мм, определяются по шкале манометра.
3. Отсоединить трубку насоса 6 от штуцера 4. Быстро нажать и отпустить рычаг клапана 3 - уравнять давление воздуха в баллоне с давлением окружающего воздуха. Когда температура в баллоне уравняется с внешней температурой (примерно через 2-3 мин), определить давление паров воздуха в баллоне по формуле h3=hл - hn.
4. Повторить измерения h1 и h3 пять раз, руководствуясь пп. 1-3. Вычислить средние значения давлений h1 и h3.
5. По формуле (29) определить отношение молярных теплоемкостей для средних значений давлений h1 и h3.
6. Определить теоретическое значение γ - по формуле (30).
7. Найти абсолютную и относительную погрешность метода измерений.
Контрольные вопросы и задания
1. Запишите и объясните первое начало термодинамики для изохорного, изобарного, изотермического и адиабатического процессов.
2. Что называют удельной и молярной теплоемкостью?
3. Какая из теплоемкостей С P или С V больше и почему?
4. Объясните уравнение Р.Майера.
5. Что называют числом степеней свободы? Как это число связано с С P, С V и γ?
6. Как и почему в опыте меняется температура газа в баллоне?
7. Запишите и объясните уравнения изотермы и адиабаты.
8. Нарисуйте на РV -диаграмме последовательно все процессы, происходящие с газом.
9. Получите рабочую формулу для определения отношения молярных теплоемкостей γ.
5. ОПРЕДЕЛЕНИЕ ИЗМЕРЕНИЯ ЭНТРОПИИ
Цель работы
Опытным путем установить зависимость изменения энтропии от теплоемкости тел при выравнивании температур тел в изолированной адиабатической термодинамической системе.
Приборы и принадлежности Калориметр, термометр, водомерный стакан, нагреватель, набор из шести: испытуемых тел: четыре железных с массами 50, 100, 150, 200 г, латунное и алюминиевое с массами 50 г каждое.
Теоретическое введение
|
|
|
Так же как и внутренняя энергия, энтропия является функцией состояния термодинамической системы. Если термодинамическая система получает в обратимом процессе количество теплоты δ Q при температуре Т, то отношение δ Q / T определяет изменение энтропии dS системы, т.е.

и. для обратимого процесса является полным дифференциалом. На практике обычно интересуются только изменением энтропии, а не ее абсолютным значением.
Изменение энтропии системы можно найти, используя второе начало термодинамики
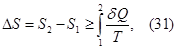
где интеграл берется по пути термодинамического процесса между состояниями 1 и 2, где S1 и S2 - значения энтропии в этих состояниях. Знак равенства соответствует обратимому процессу, а знак неравенства - необратимому.
Второе начало термодинамики (31) утверждает, что при обратимом процессе изменение энтропии системы равно интегралу от 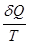 между состояниями 1 и 2 по обратимому пути и больше этого интеграла по пути необратимому, т.е. в этом случае интеграл от
между состояниями 1 и 2 по обратимому пути и больше этого интеграла по пути необратимому, т.е. в этом случае интеграл от 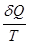 не выражает изменение энтропии, а меньше его.
не выражает изменение энтропии, а меньше его.
Представляет интерес изучение изменения энтропии в изолированной адиабатической системе.
Изменение энтропии в изолированной адиабатической системе при квазистатическом (обратимом) процессе равно нулю, так как 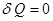 , т.е.
, т.е.

В случае необратимых процессов в изолированной адиабатической системе 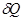 также равно нулю, но изменение энтропии в такой системе уже нулю не равно и по формуле (31) для обратимых процессов не может быть вычислено. Это вычисление можно сделать, если учесть, что энтропия есть функция состояния системы и ее применение не зависит от характера пути процесса в системе, т.е. обратимого или необратимого. В этом случае для вычисления изменения энтропии можно воспользоваться любым квазистатическим (обратимым) процессом, переводящим систему из состояния 1 в 2, т.е.
также равно нулю, но изменение энтропии в такой системе уже нулю не равно и по формуле (31) для обратимых процессов не может быть вычислено. Это вычисление можно сделать, если учесть, что энтропия есть функция состояния системы и ее применение не зависит от характера пути процесса в системе, т.е. обратимого или необратимого. В этом случае для вычисления изменения энтропии можно воспользоваться любым квазистатическим (обратимым) процессом, переводящим систему из состояния 1 в 2, т.е.
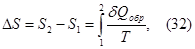
В случае выравнивания температуры от T1 до Т2 твердых и жидких тел в изолированной адиабатической системе этот реальный процесс можно заменить изобарическим квазистатическим (обратимым) переходом теплоты между телами. При изобарическом процессе
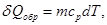
где т - масса тела; СР – удельная теплоемкости тела при постоянном давлении. Для характеристики теплоемкости тел используется также и удельная теплоемкость при постоянном объеме – С V. У жидких и твердых тел разница между Ср и С V сравнительно мала, так что можно положить Ср ≈ С V и говорить просто об удельной теплоемкости жидких и твердых тел С. Нужно помнить, что удельная теплоемкость вещества С зависит от температуры, т.е. С = C(Т). Тогда изменение энтропии в этом процессе можно определить
|
|
|
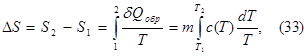
В нашем случае вместо C (Т) будем использовать среднее значение удельной теплоемкости С в интервале температур от T1 до Т2 и считать для этого температурного интервала среднее значение удельной теплоемкости С величиной постоянной, тогда изменение энтропии будем вычислять по формуле:
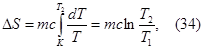
В силу того, что энтропия аддитивна, полное изменение энтропии термодинамической системы можно найти, если просуммировать изменения энтропии всех отдельных тел, входящих в состав этой системы, т.е.
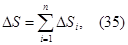
где ∆ S - изменение энтропии всей системы; n - число тел системы; ∆ S i - изменение энтропии одного из тел термодинамической системы.
|
|
|


