 |
Согласно первому началу термодинамики
|
|
|
|
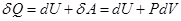
сообщаемое термодинамической системе тепло 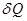 идет на изменение внутренней энергии системы d U и совершение системой работы
идет на изменение внутренней энергии системы d U и совершение системой работы 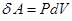 над внешними телами. В случае твердого и жидкого тел все сообщаемое тепло идет на изменение внутренней энергии, а так как объемы этих тел при нагревании почти не изменяются, то работой расширения
над внешними телами. В случае твердого и жидкого тел все сообщаемое тепло идет на изменение внутренней энергии, а так как объемы этих тел при нагревании почти не изменяются, то работой расширения 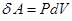 можно пренебречь, т.е., чем больше изменение энтропии в адиабатно-изолированной системе, тем большее количество тепла необратимо переходит во внутреннюю энергию системы. Поэтому необратимые потери тепла, связанные с реальными необратимыми термодинамическими процессами в адиабатно-изолированных системах, принято оценивать по изменению энтропии.
можно пренебречь, т.е., чем больше изменение энтропии в адиабатно-изолированной системе, тем большее количество тепла необратимо переходит во внутреннюю энергию системы. Поэтому необратимые потери тепла, связанные с реальными необратимыми термодинамическими процессами в адиабатно-изолированных системах, принято оценивать по изменению энтропии.
Если в калориметр, содержащий определенное количество воды при заданной температуре, опустить нагретое тело, то произойдет теплообмен и установится общая температура. Сам калориметр помещен во внешний стакан, в результате чего система становится почти адиабатно-изолированной.
Термодинамическому равновесию адиабатической системы соответствует состояние с максимумом энтропии, при этом температура вест частей системы в состоянии равновесия одинакова.
Изменение энтропии такой системы при выравнивании температуры погруженного тела и воды можно рассчитать по формулам (34) и (35). В состав исследуемой системы входят: испытуемое тело массой mT с удельной теплоемкостью СT и начальной температурой Т0, вода калориметра массой mВ с удельной теплоемкостью СВ и начальной температурой Т0. После окончания процесса теплообмена установится температура Т.
При выравнивании температуры энтропия каждого из тел изменяется:
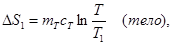
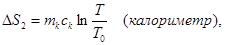
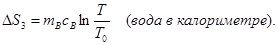
Учитывая аддитивность энтропии (35), можно записать
|
|
|
∆ S = ∆ S 1 + ∆ S 2 + ∆ S 3.
Подставляя значения ∆S1, S2, S3, получим расчетную формулу изменения энтропии всей системы

В данной работе
 mB = 0,2 кГ; СВ = 4,18*103 Дж/кГ*град (при t =20º C);
mB = 0,2 кГ; СВ = 4,18*103 Дж/кГ*град (при t =20º C);
С T (железо)= 460,5 Дж/кГ*град;
С T (латунь)= 376,7 Дж/кГ*град;
С T (алюминий)= 879,1 Дж/кГ*град.
В работе предлагается рассчитать изменение энтропии шести нагретых тел при опускании в калориметр с водой, температура и масса которой одинаковы в каждом эксперименте.
Порядок выполнения работы
1. Опустить в нагреватель испытуемое тело. Включить нагреватель.
2. Пока тело нагревается до температуры T1 кипения воды, наполнить водой водомерный стакан (200 см) и вылить ее в стакан калориметра. По термометру определить начальную температуру Т0 воды и калориметра.
3. После того как вода в нагревателе будет кипеть не менее 5 мин, отключить нагреватель, перенести за нить исследуемое тело в калориметр и быстро закрыть его.
4. По термометру калориметра следить за ростом температуры воды и записать в таблицу ее максимальное значение T.
5. Вылить воде из стакана калориметра и отладить его под струёй воды.
6. Действия, перечисленные в пп. 1-5, повторить с каждым из тел.
7. Определить теплоемкость C каждого из тел и результаты занести в табл.1.
8. По формуле (36) найти изменение энтропии ∆S для каждого из тел и записать в табл.1. Вычислить погрешность метода измерения для самого легкого тела (максимальную погрешность).
9. По данным табл. 1 построить график зависимости ∆ S=f(С).
Таблица 1
| Исследуе-мое тело | Fe 0,05 кг | F0 0,1 кг | Fe 0,15 кг | Fe 0,2 кг | Al 0,05 кг | Латунь 0,05 кг |
Т(К)
С(Дж/К)
∆ S(Дж/К)
Контрольные вопросы и задания
1. Что такое обратимые и необратимые процессы?
2. Охарактеризуйте энтропию и ее изменение.
3. Что такое термодинамическая вероятность состояния (статистический вес).
|
|
|
4. Статистический смысл изменения энтропии.
5. Первый закон термодинамики.
6. Вывод рабочей формулы (36) данной работы.
7. Второй закон термодинамики и его статистический смысл.
6. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ И УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ МЕТАЛЛА
Цель работы
Исследовать фазовый переход первого рода на примере плавления и кристаллизации металла. Определить температуру, удельную теплоту плавления металла и изменение энтропии при плавление и кристаллизации.
Приборы и принадлежности
Тигель с исследуемым металлом, термопара, нагреватель, термометр, цифровой вольтметр, секундомер.
Теоретическое введение
Сильное нагревание твердого тела может привести к разрушению его кристаллической решетки и к переходу вещества из твердой фазы в жидкую. Фазовое превращение, сопровождающееся поглощением или выделением количества теплоты и изменением удельного объема (объема, занимаемого единицей массы), называется фазовым переходом первого роди. Плавление (переход вещества из твердого состояния в жидкое) и обратный процесс (кристаллизация) для многих кристаллических веществ является фазовым переходом первого рода. Такой переход всегда изотермичен. Во время фазового переходе сохраняется.двухфазное состояние (например, жидкое и твердое), но плавно меняется соотношение масс каждой фазы. Температура перехода зависит от давления. Если при определенном давлении сообщать твердому телу за равные малые промежутки времени одинаковое количество тепла Q, то абсолютная температура тела будет изменяться в соответствии с графиком рис.5. Участок AB представляет собой нагревание твердого тела до температуры плавления Тn.
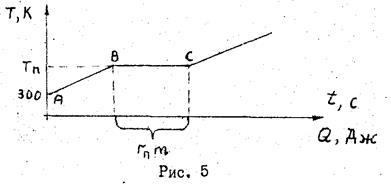
Для кристаллических тел в точке 6 прекращается дальнейшее повышение температуры. Изотермический участок ВС характеризует переход тела из твердого состояния в жидкое и соответствует одновременному существованию двух фаз: твердой и жидкой. На участке BС при плавлении телом поглощается определенное количество теплоты при постоянной температуре. Это количество теплоты, рассчитанное на единицу массы тела, называется удельной теплотой плавления rп. Обозначим через UЖ и UТ внутренние анергии единицы массы вещества в точках С и B, соответствующих жидкой и твердой фазам и через Vж и VT - удельные объемы жидкости и твердого тела. Тогда по первому закону термодинамики удельная теплота плавления может быть выражена так:
|
|
|
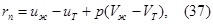
где р - постоянное давление, при котором совершается фазовый переход.
Для фазовых переходов первого рода можно рассчитать изменение энтропии по формуле Клаузиуса
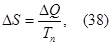
В данном случае
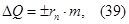
где т - масса тела. Знак "+" соответствует поглощению телом количества теплоты (плавлению), знак "-" - кристаллизации, которая сопровождается выделением количества теплоты.
Процесс плавления представляет совой переход вещества из более упорядоченного кристаллического состояния в менее упорядоченное - жидкое. По второму закону термодинамики такой переход должен сопровождаться возрастанием энтропии вещества.
При охлаждении большинства жидкостей до некоторой температуры, зависящей от давления и состава жидкости, начинается процесс кристаллизации - перехода вещества из жидкой фазы в твердую. Он связан с выделением теплоты, равной теплоте плавления, и для химически чистых жидкостей протекает при постоянной температуре, равной температуре плавления.
Качественно процесс кристаллизации, как и процесс плавления, можно объяснить изменением характера теплового движения частиц вещества. Под влиянием сил взаимного притяжения между частицами их движение при охлаждении вещества в конце концов превращается в хаотические тепловые колебания около некоторых неизменных средних положений - узлов кристаллической решетки.
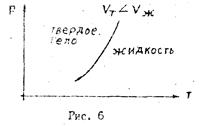
Зависимость температуры плавления твердых тел от давления показана на графике рис.6 (кривая плавления). Это кривая равновесия двухфазной системы твердое тело - жидкость, разделяющая друг от друга области существования твердой и жидкой фаз. Другой разновидностью фазового переходи первого рода является переход вещества из жидкой фазы в газообразную и обратно.
|
|
|
Фазовые переходы второго рода не связаны с поглощением или выделением теплоты фазового перехода. При этих переходах скачком изменяются какие-либо из параметров системы - теплоемкость, коэффициент теплового расширения и некоторые другие характеристики вещества. Пример такого перехода - превращение ферромагнетика в парамагнетик в точке Кюри.
|
|
|


