 |
Измерение электродных потенциалов
|
|
|
|
Для экспериментального определения электродных потенциалов используют электрохимические цепи или гальванический элемент.
Гальванический элемент – это такое устройство, в котором энергия химической реакции превращается в электрическую. Гальванический элемент состоит из двух и более электродов. Один электрод получил название полуэлемент.

Рис. 5.
Полуэлемент
В лабораторном практикуме используют полуэлементы, состоящие из электронного проводника – металла 1, погруженного в раствор электролита 2, помещенного в сосуд 3 с сифоном 4, краном 5, патрубком 6, который герметично закрыт пробкой 7 (рис.5). Это электрод первого рода.
В качестве второго электрода используют электрод сравнения -хлорсеребряный электрод.
Два электрода соединены между собой солевым мостиком.
Солевой мостик представляет собой изогнутую трубку, заполненую гелем, на основе раствора электролита, например, хлорида калия, содержащим желатин или агар-агар.
Для измерения потенциала металлического электрода относительно хлорсеребряного электрода сравнения составляют электрохимическую цепь (систему) из исследуемого электрода и электрода сравнения, которую, схематично можно изобразить следующим образом:
(-) Zn | Zn2+ || KCl | AgCl, Ag (+),
где две вертикальные линии обозначают солевой мостик, подключают к концам цепи потенциометр или катодный вольтметр (стрелочный или цифровой) с высоким входным сопротивлением (109 – 1012 Ом) и измеряют электродвижущую силу (ЭДС) цепи. ЭДС цепи DЕ равна разности потенциалов хлорсеребряного Ех/с и цинкового Ех электродов:
DЕ = Ех/с – Ех
Принцип действия и порядок работы на потенциометре или катодном вольтметре излагаются в прилагаемых к этим приборам инструкциях.
|
|
|
ЭДС – величина положительная, экспериментальная величина. Таким образом, из уравнения следует, что
Ех =Ех/с - DЕ
Для справки:
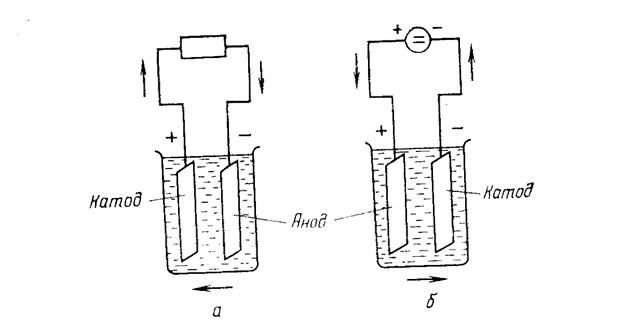
Рис.6.
Направление тока при работе гальванической ячейки в качестве химического источника тока (а) и электролизера (б)
Возможны два направления прохождения тока через гальваническую ячейку — естественное и вынужденное. Если замкнуть ячейку с помощью электронных проводников, то ток по внешнему участку цепи потечет от положительного электрода ячейки к отрицательному, а внутри ячейки - от отрицательного к положительному (рис. 6. а). В этом случае ток возникает из-за собственного напряжения ячейки, т. е. она будет действовать как химический источник тока.
Если же во внешней цепи имеется источник тока большего напряжения, включенный навстречу ячейки, то под его влиянием ток пойдет в обратном направлении (рис. 6.б), и ячейка будет работать как электролизер.
Отсюда вытекает, что в химическом источнике тока отрицательный электрод является анодом, положительный — катодом. Для определения анода и катода сравнивают стандартные электродные потенциалы. В электролизере, наоборот, отрицательный электрод катодом, положительный — анодом. Поэтому следует внимание на то, что понятия «анод» и «катод» связаны с направлением тока, но не с полярностью электродов гальванической ячейки.
Работа 3. Определение концентрации электролита методом прямой потенциометрии
Цель работы: Освоить метод прямой потенциометрии, получить калибровочный график– зависимость Е = f(lnCх);
Сравнить экспериментальные значения потенциалов с величинами, рассчитанными по уравнению Нернста;
Определить концентрацию электролита.
Оборудование и реактивы: 4 мерные колбы на 100 мл;
4 химических стаканов на 100мл;
4 полуэлемента с подставками;
|
|
|
4 металлические электрода;
хлорсеребряный электрод;
переходный (соединительный) мостик;
груша;
подставка для гальванического элемента;
потенциометр и цифровой вольтметр;
исходный 1 М раствор электролита, оборудованный бюреткой.
Выполнение работы начинают с приготовления растворов заданных составов определенной концентрации методом разбавления в мерной колбе на 100 мл.
Поверхность металлического электрода обрабатывают тонкой наждачной бумагой до равномерного блеска, промывают дистиллированной водой, обтирают фильтровальной бумагой и промывают в органическом растворителе для обезжиривания.
Затем собирают полуэлемент, для чего промывают сосуд 3 (рис. 5) дистиллированной водой, ополаскивают его раствором, который будет служить электролитом, и плотно закрывают пробкой 7, в которую вставлен электронный проводник 1. Надевают грушу на патрубок 6, открывают кран 5, выдувают из груши воздух и закрывают кран. Погрузив сифон 4 в стакан с раствором электролита, открывают кран 5 и засасывают электролит 2 в сосуд, следя за тем, чтобы в сифоне не было пузырьков воздуха, после чего закрывают кран. Если полуэлемент собран герметично, то капли электролита на кончике сифона не образуются. При некачественной сборке полуэлемента электролит из сосуда будет вытекать.
При составлении электрохимической цепи, сифон полуэлемента погружают в стакан с раствором электролита, которым заполнен полуэлемент, хлорсеребряный электрод погружают его в стакан с насыщенным раствором хлорида калия и соединяют электролиты солевым мостиком. Подключают к концам цепи потенциометр или катодный вольтметр и проводят измерение ЭДС.
После измерения ЭДС необходимо определить знак и значение потенциала исследуемого электрода относительно электрода сравнения. Зная потенциал хлорсеребряного электрода относительно стандартного водородного электрода сравнения, рассчитывают потенциалы исследуемых электродов относительно СВЭ.
Сравнивают полученные значения потенциалов с величинами, рассчитанными по уравнению Нернста. После чего строят калибровочный график – зависимость Е = f(lnCх), которая обычно представляет собой прямую линию.
Затем проводят измерения с раствором, выданным преподавателем, определяют концентрацию электролита и проводят анализ полученных результатов.
|
|
|


