 |
По равновесию химической реакции с газовой фазой
|
|
|
|
Реальные растворы. Метод активностей. Определение активности по давлению пара.
Реальными называются р-ры, кот. не подчиняются законам ид. р-ров. Обычно они составлены из компонентов с различными св-вами, строением молекул и силами взаимодействия между молекулами компонентов. Образование таких р-ров сопровождается изменением объема и тепловыми эффектами. С уменьшением концентрации реального раствора его свойства приближаются к свойствам идеального раствора.
Методы определения активности
Экспериментальные методы определения активности компонентов в растворе основаны на изучении какого-либо гетерогенного равновесия в системе. При рассмотрении этих методов следует помнить, что в условиях равновесия химические потенциалы i-го компонента в разных фазах (I и II) равны:
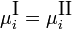
Это соотношение является исходной точкой для вывода расчетных уравнений в некоторых из методов определения активности. Кроме того, активности компонентов в некоторой фазе связаны между собой уравнением:
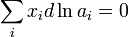
По равновесному давлению пара
В основе этого метода лежит соотношение:
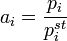
где  — парциальное давление пара компонента над раствором, а
— парциальное давление пара компонента над раствором, а 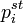 — давление пара этого компонента для стандартного состояния (см. выше). Соответственно, если за стандартное состояние принято состояние чистого компонента, то
— давление пара этого компонента для стандартного состояния (см. выше). Соответственно, если за стандартное состояние принято состояние чистого компонента, то 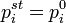 .
.
Эксериментальные методы определения давления пара компонентов над раствором весьма разнообразны; выбор того или иного из них определяется, в частности, исследуемой системой (водный раствор или иная низкотемпературная система, либо расплавленный металл, шлак, штейн и т. п.).
По повышению температуры кипения раствора
Т кипения раствора 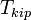 выше Т кипения чистого р-ля
выше Т кипения чистого р-ля 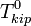 . Данные об изменении Т кипения р-ра могут быть использованы для расчета активности р-ля, в соответствии с ур-ем:
. Данные об изменении Т кипения р-ра могут быть использованы для расчета активности р-ля, в соответствии с ур-ем:
|
|
|
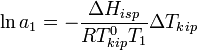 ,
,
где 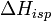 — теплота испарения р-ля, в интервале от Т кипения чистого р-ля до Т кипения р-ра принимаемая постоянной. Индексом «1» обычно обозначается р-ль.
— теплота испарения р-ля, в интервале от Т кипения чистого р-ля до Т кипения р-ра принимаемая постоянной. Индексом «1» обычно обозначается р-ль.
По понижению температуры замерзания раствора
Т замерзания р-ра 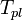 ниже Т замерзания чистого растворителя
ниже Т замерзания чистого растворителя 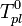 . Соответственно, активность р-ля можно рассчитать, используя зависимость:
. Соответственно, активность р-ля можно рассчитать, используя зависимость:
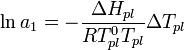 ,
,
где 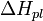 — теплота плавления р-ля.
— теплота плавления р-ля.
По осмотическому давлению раствора
Величина осмотического давления раствора может быть использована для определения активности растворителя в соответствии с соотношением:
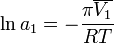
где  — осмотическое давление,
— осмотическое давление, 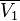 — парциальный молярный объём р-ля.
— парциальный молярный объём р-ля.
По распределению компонента между конденсированными фазами
Активность компонента раствора можно определить, изучая равновесное распределение его между двумя контактирующими конденсированными фазами (различными растворителями, сплавом и шлаком, шлаком и штейном и т. п.), одна из которых — исследуемый раствор, а для другой активность или коэфф. активности уже известны. В общем случае:
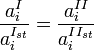
В частности, если выбор стандартного состояния компонента для фаз таков, что 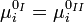 , это выражение принимает более простой вид:
, это выражение принимает более простой вид:
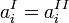
Экспериментально в этом методе определяют равновесные концентрации компонента или коэффициент распределения компонента между р-рами.
По равновесию химической реакции с газовой фазой
При исслед. оксидных р-вов активность компонентов часто определяют, использ. следующие хим. р-ции:
MeO + H2 = Me + H2O
MeO + CO = Me + CO2
Для первой из приведенных реакций константа равновесия имеет вид:

Если оксидный и металлический расплавы взаимно нерастворимы и восстанавливается индивидуальный оксид, то 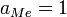 , и тогда:
, и тогда:

Если металл выделяется в виде сплава с другими компонентами или растворяется в фазе-коллекторе, его активность не равна единице и формула принимает вид:
|
|
|
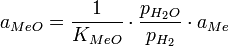
Активность металла в сплаве здесь должна быть известна из независимых измерений.
Опытным путем в данном методе определяют отношение 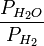 .
.
Кроме того, активность оксидного компонента связана с равновесным давлением кислорода над расплавом, с учетом реакций в газовой фазе, например:
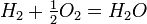
или

Тогда можно показать, что 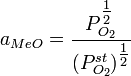
Для сульфидных расплавов используют реакцию:
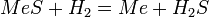
или (значительно реже):
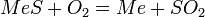
|
|
|


