 |
Теория Аррениуса для слабых электролитов. Закон разведения Оствальда.
|
|
|
|
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс. Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:
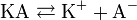
Константа диссоциации Kd определяется активностями катионов  , анионов
, анионов 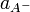 и недиссоциированных молекул
и недиссоциированных молекул  следующим образом:
следующим образом:
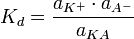
Значение Kd зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения:
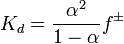 ,
,
где 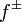 — средний коэффициент активности электролита.
— средний коэффициент активности электролита.
В растворах слабых электролитов  и
и  0 связаны со степенью диссоциации
0 связаны со степенью диссоциации  электролита уравнением Аррениуса:
электролита уравнением Аррениуса:
 .
.
Кроме того, выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
|
|
|
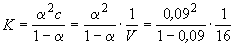 ,
,
где K - константа диссоциации слабого электролита.
Активность иона. Средний ионный коэффициент активности. Теория Дебая-Хюккеля.
Активность электролитов
Переносчиками эл. тока в р-рах электролитов являются ионы, образующиеся при диссоциации молекул электролитов. Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными св-вами.
Ур-я, описывающие коллигативные св-ва неэлектролитов, можно применить и для описания св-тв ид. р-ров электролитов, если ввести поправочный изотонический коэфф. Вант-Гоффа i, например:
 осм. = iCRT или
осм. = iCRT или  T зам. = iKm.
T зам. = iKm.
Изотонический коэффициент связан со степенью диссоциации  электролита:
электролита:
i = 1 +  (n - 1),
(n - 1),
где n - количество ионов, образующихся при диссоциации одной молекулы.
Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона ai выражается в виде произведения концентрации иона mi на его коэффициент активности  i:
i:
ai =  i mi.
i mi.
Экспериментально определить активности катиона a + и аниона a - невозможно, поэтому вводится понятие средней ионной активности a  . Для электролита, образующего n + катионов и n - анионов,
. Для электролита, образующего n + катионов и n - анионов,
 ,
,
где n = n + + n -.
Аналогично определяют средний ионный коэффициент активности 


и среднюю ионную моляльность m 
 ,
,
где 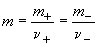 - моляльность электролита.
- моляльность электролита.
Активность электролита определяется как

Согласно закону ионной силы, коэфф. активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора:
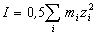 ,
,
где zi - заряд иона (в единицах заряда протона), mi - его моляльная концентрация.
Согласно первому приближению теории Дебая-Хюккеля, можно рассчитать как коэфф. активности  i отдельного иона
i отдельного иона
 ,
,
так и средний ионный коэффициент активности 
 :
:
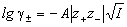 ,
,
где z + и z - заряды катиона и аниона, I - ионная сила раствора, A - константа, зависящая от диэлектрической проницаемости растворителя и температуры. Для водного раствора при 25o C A = 0.509.
|
|
|
ТЕОРИЯ ДЕБАЯ - ХЮККЕЛЯ, статистич. теория разбавленных р-ров сильн. электролитов, позволяющая рассчитать коэф. активности ионов. Основана на предположении о полной диссоциации электролита на ионы, кот. распределены в р-ле, рассматриваемом как непрерывная среда. Каждый ион действием своего электрич. заряда поляризует окружение и образует вокруг себя нек-рое преобладание ионов противоположного знака - т. наз. ионную атмосферу. В отсутствие внеш. эл. поля ионная атмосфера имеет сферич. симметрию и ее заряд равен по величине и противоположен по знаку заряду создающего ее центр. иона.
|
|
|


