 |
Приготовление титрованных растворов
|
|
|
|
Титрованные растворы
Для количественного определения в фармацевтическом анализе широко применяются титриметрические методы: ацидиметрия, алкалиметрия, нитритометрия, броматометрия, йодометрия, комплексонометрия и др.
Для проведения расчетов в титриметрическом анализе используют такие величины, как «моль», «условная частица» вещества или «эквивалент», титрованный раствор и т.д. Поэтому сначала остановимся на этих понятиях.
Любое вещество состоит из формульных (структурных) единиц (ФЕ). ФЕ в химии – это реально существующие частицы: атомы, молекулы, ионы, радикалы.
В Международной системе единиц (СИ) за единицу количества вещества принят МОЛЬ. Моль – это количество простого или сложного вещества, содержащее столько специфицированных структурных единиц вещества (молекул, атомов, ионов, электронов), сколько содержится атомов в 12 г изотопа углерода 12С. В 12 г изотопа 12С содержится 6,022´1023 атомов. Это число называется постоянной Авогадро.
Таким образом, число структурных элементов в моль любого вещества 6,022´1023. Можно говорить о моль атомов, молекул, ионов, электронов.
1 моль H2SO4 – это 6,022´1023 молекул H2SO4.
1 моль H2SO4 содержит 2 моль Н+ ионов (12,044´1023 отдельных ионов) и 1 моль SO42– (6,022´1023 отдельных ионов).
Молярная масса вещества (МВ, кг/моль, г/моль) – это масса вещества, взятого в количестве 1 моль. Значение молярной массы вещества численно равно значению относительной молекулярной массы этого вещества (Mr(B)).
МКОН = 56,10 г/моль; Mr(KOH) = 56,10
Число моль вещества (nB) равно массе вещества (г), деленной на его молярную массу (г/моль):
m B
n B = -------
M B
Пример. Сколько моль NaCl содержится в 292,2 г?
M NaCl = 58,44 г/моль
292,2 г
n NaCl = ----------------- = 5 моль
|
|
|
58,44 г/моль
В основе титриметрических методов анализа лежит закон эквивалентов: химические элементы и их соединения вступают в химические реакции друг с другом в строго определенных массовых количествах, соответствующих их химическим эквивалентам. Основное уравнение титриметрии:
V1 ´ C1 = V2 ´ C2, где
V1, V2 - объем растворов;
С1, С2 – молярные концентрации эквивалентов реагирующих веществ.
Для вычисления молярной концентрации эквивалента (или молярной концентрации условной частицы по ГФ Х1) вводится фактор эквивалентности и эквивалентное число.
Эквивалентное число (ZB) соответствует числу принятых (отданных) электронов в реакциях окисления – восстановления, переносу одной единицы заряда в обменных реакциях (осаждения, замещения, нейтрализации), лежащих в основе титриметрического метода. Фактор эквивалентности (fэкв (В)) показывает, какая часть формульной единицы (ФЕ) соответствует эквиваленту и рассчитывается по формуле:
1
f экв (B) = -------
Z B
Эквиваленты – это условные частицы (УЧ) вещества, в ZB раз меньшие, чем соответствующие им формульные единицы. В одной формульной единице вещества В может содержаться ZB эквивалентов этого вещества.
Примеры.
1. H2SO4 + 2KOH ® K2SO4 + 2H2O
Z H2SO4 = 2; Z KOH = 1
f экв (H2SO4)= 1/2; f экв (КОН) = 1
2. 2KMnO4 + 10FeSO4 + 8H2SO4 ® K2SO4 + 2MnSO4 + 5Fe2(SO4)3 + 8H2O
Z KMnO4 = 5; Z FeSO4 = 1
f экв (KMnO4) = 1/5; f экв (FeSO4) = 1
Количество вещества эквивалентов (n экв (B), моль) определяется по формуле:
n экв (B) = Z B ´ n B, где
Z B - эквивалентное число;
n B - количество вещества (моль).
Пример. 2CuSO4 + 4KI ® 2CuI + I2 + 2K2SO4
Cu+2 + ē ® Cu+1
Одна ФЕ катиона Cu+2 принимает один электрон, поэтому Z CuSO4 = 1;
n экв (CuSO4) = Z CuSO4 ´ n CuSO4 = 1 ´ 2 = 2 моль
Молярная масса эквивалента (условной частицы) (М экв (В), г/моль) – отношение молярной массы вещества (г/моль) к эквивалентному числу (или величина, равная произведению фактора эквивалентности на молярную массу вещества):
М В
|
|
|
М экв (В) = --------- или М экв (В), = f экв (В) ´ М В
Z
Примеры.
М H2SO4 1
М экв (H2SO4) = ------------ = ----- ´ М H2SO4
2 2
М KOH
М экв (KOH) = ------------ = 1 ´ М KOH
М KMnO4 1
М экв (KMnO4) = ------------ = ----- ´ М KMnO4
5 5
М FeSO4
М экв (FeSO4) = ------------ = 1 ´ М FeSO4
Молярная масса эквивалента равна массе условной частицы (УЧ) по ГФ Х1 издания.
Расчет эквивалентного числа (Z B), фактора эквивалентности (f экв (В))
и молярной массы эквивалента вещества (М экв (В))
1. Реакции нейтрализации.
Z кислоты равно числу реакционноспособных ионов водорода.
1
f экв (кислоты) = ------------
Z кислоты
Примеры.
Для кислоты серной (H2SO4):
Z H2SO4 = 2; f экв (H2SO4) = 1/2;
М H2SO4 98,08
М экв (H2SO4) = ------------ = -------- = 49,04 г/моль
Z H2SO4 2
Для кислоты фосфорной (H3РO4):
Z H3РO4 = 2; f экв (H3РO4) = 1/2;
М H3РO4 98,00
М экв (H3РO4) = ------------ = ------- = 49,00 г/моль,
Z H3РO4 2
т.к. Н3РО4 + 2NaOH ® Na2HPO4 + 2H2O
Z основания равно числу ионов водорода, требуемых для нейтрализации одной молекулы основания.
1
f экв (основ.) = ------------
Z основ.
Пример.
Для натрия гидроксида (NaOH):
Z NaOH = 1; f экв (NaOH) = 1;
М NaOH 40,00
М экв (NaOH) = ------------ = -------- = 40,00 г/моль
Z NaOH 1
2. Реакции осаждения, комплексообразования.
Z вещества равно числу однозарядных ионов, реагирующих с одной молекулой вещества.
1
f экв (В) = -------------
заряд иона
Примеры.
NaCl + AgNO3 ® AgCl ¯ + NaNO3
Z NaCl = 1; f экв (NaCl) = 1;
М NaCl 58,44
М экв (NaCl) = ------------ = -------- = 58,44 г/моль
Z NaCl 1
CaCl2 + 2AgNO3 ® 2AgCl ¯ + Ca(NO3)2
Z CaCl2 = 2; f экв (CaCl2) = 1/2;
М CaCl2 219,08
М экв (CaCl2) = ------------ = ---------- = 109,54 г/моль
Z CaCl2 2
3. Окислительно-восстановительные реакции.
Z вещества равно числу электронов, получаемых или отдаваемых в процессе реакции одной молекулой вещества.
1
fэкв (В) = ------------
число ē
Пример.
2KMnO4 + 10KI + 8H2SO4 ® 5I2 + 6K2SO4 + 2MnSO4 + 8H2O
+5 ē
Mn+7 ¾® Mn+2
Z KMnO4 = 5; f экв (KMnO4) = 1/5;
М KMnO4 158,04
М экв (KMnO4) = ------------ = --------- = 31,61 г/моль
Z KMnO4 5
Следует отметить, что эквивалентное число и фактор эквивалентности – условные числа. Иногда при расчете Z B и f экв (В) учитывают Z и f титранта.
Пример.
KBrO3 + 5KBr + 6HCl ® 3Br2 + 6KCl + 3H2O
Br2 + 2KI ® I2 + 2KBr
I2 + 2Na2S2O3 ® 2NaI + Na2S4O6
Калия бромат определяют косвенно по количеству выделившегося брома, который при взаимодействии с калия йодидом дает эквивалентное количество йода. Йод оттитровывают натрия тиосульфатом.
|
|
|
KBrO3 ® 3Br2 ® 3I2 ® 6Na2S2O3
1 молекула 6 молекул
–2 ē
2S2O3–2 ¾® S4O6–2
6 молекул отдают 6 электронов, поэтому Z KBrO3 = 6, f экв (KBrO3) = 1/6,
М KBrO3
М экв (KBrO3) = ------------
Если рассчитывать Z и f по количеству принятых электронов,
+5 ē
то Z KBrO3 = 5, f экв (KBrO3) = 1/5, т.к. Br+5 ¾® Br0
В титриметрических методах используют титрованные или стандартные растворы.
Титрованный раствор – это раствор точно известной концентрации, предназначенный для целей титрования в титриметрическом анализе.
Согласно ИЮПАК, концентрация титрованных растворов выражается различными способами.
1. Молярная концентрация вещества (С В , моль/л, моль/дм3) – это отношение количества растворенного вещества (в моль) к объему раствора (или число моль вещества в одном литре раствора).
nB число моль
СВ = ------- или СВ = ----------------, где
Vp Vp
n B - количество вещества (моль);
Vp - объем раствора (л).
В ГФ Х1 (вып. 2) приведены молярные растворы: аммония роданида (0,1 моль/л), кали едкого спиртового (0,5 моль/л, 0,1 моль/л), натра едкого (1 моль/л, 0,5 моль/л, 0,1 моль/л, 0,05 моль/л и др.), натрия метилата (0,1 моль/л), натрия нитрита (0,1 моль/л), натрия тиосульфата (0,1 моль/л), трилона Б (0,05 моль/л), кислоты хлороводородной (1 моль/л, 0,1 моль/л и др.), кислоты хлорной (0,1 моль/л и др.), серебра нитрата (0,1 моль/л), свинца нитрата (0,05 моль/л), церия сульфата (0,1 моль/л), тетраэтиламмония гидроокиси (0,1 моль/л).
2. Молярная концентрация эквивалентов вещества (С экв (В), моль/дм3, моль/л) – это отношение количества вещества эквивалентов к объему раствора (или количество вещества эквивалентов в одном литре раствора).
n экв (В)
С экв (В) = ---------, где
Vp
n экв (В) - количество вещества эквивалентов (моль);
Vp - объем раствора (л).
В ГФ Х1 (вып. 2) приведено 8 растворов с молярной концентрацией эквивалентов вещества (УЧ): раствор йода (0,1 моль/л), УЧ (1/2 I2); йодмонохлорида (0,1 моль/л), УЧ (1/2 IСl); калия бромата (0,1 моль/л), УЧ (1/6 KbrO3); калия дихромата (0,1 моль/л), УЧ (1/6 K2Cr2O7); калия йодата (0,1 моль/л), УЧ (1/6 KIO3); калия перманганата (0,1 моль/л), УЧ (1/5 KMnO4); ртути окисной нитрата (0,1 моль/л), УЧ [1/2 Hg(NO3)2]; кислоты серной (0,1 моль/л), УЧ (1/2 H2SO4).
|
|
|
В практике фармацевтического анализа пользуются величиной «титр» (Т).
1. Титр – концентрация раствора, равная массе вещества (г) в 1 мл раствора.
m В
ТВ = ---------, где
Vp
ТВ – титр раствора вещества В (г/мл);
mВ - масса вещества (г);
Vp - объем раствора (мл).
Например, для 1% раствора калия йодида Т KI = 0,01000 г/мл.
2. Титр титрованного раствора (титранта) – масса вещества (г) в 1 мл титрованного раствора. Расчет титра проводят в зависимости от способа выражения концентрации раствора.
а) Растворы с молярной концентрацией вещества:
МВ ´ СВ
Т р (В) = ---------------, где
1000
Т р – титр раствора (г/мл);
М В – молярная масса вещества (г/моль);
С В – молярная концентрация раствора (моль/л).
б) Растворы с молярной концентрацией эквивалентов вещества:
М экв (В) ´ С экв (В)
Тр (В) = ------------------------, где
1000
М экв (В) – молярная масса эквивалентов вещества (г/моль);
С экв (В) – молярная концентрация эквивалентов вещества (моль/л).
3. Титр анализируемого вещества – масса вещества (г), которая реагирует с 1 мл титрованного раствора. Расчет проводится аналогично титру титрованного раствора.
Титр рассчитывают до 4-х значащих цифр. Нули в начале числа не являются значащими цифрами.
Титрованные (стандартные) растворы – это растворы реагентов с точно известной концентрацией, применяемые в титриметрическом анализе. Различают первичные и вторичные стандартные растворы.
Первичные стандартные растворы получают растворением навески реагента (взятой на аналитических весах с точностью до 0,0001 г) в определенном объеме растворителя, в мерной колбе. Поправочный коэффициент к молярной концентрации (К) такого раствора принимается равным 1,000. Для приготовления первичных стандартных растворов могут использоваться стандартные вещества, отвечающие ряду требований: 1) быть химически чистыми; 2) строго отвечать химической формуле; 3) быть устойчивыми как в твердом виде, так и в растворе. К таким веществам относятся: KBrO3, KIO3, K2Cr2O7, H2C2O4.
Вторичные стандартные растворы (или растворы с установленным титром) готовят из веществ, не имеющих постоянного состава, или веществ, которые нельзя получить в достаточно чистом виде, а также из веществ, концентрация которых изменяется при хранении. К ним относятся NaOH, HCl, I2 и многие другие. При приготовлении этих растворов нет необходимости брать точную навеску вещества, т.к. невозможно получить раствор с точно известной концентрацией. Поэтому берется навеска вещества, примерно на 10% большая, чем по расчету. Отвешивают или отмеривают это количество вещества и растворяют в необходимом количестве растворителя, в мерной колбе. Концентрация вторичных стандартных растворов отличается от теоретически заданной. У таких растворов устанавливается поправочный коэффициент к молярной концентрации (К) титрованных растворов. К показывает во сколько раз крепче или слабее приготовленный раствор по сравнению с раствором точно заданной концентрации.
|
|
|
Титрованные растворы готовят также из фиксаналов. Фиксаналы – это запаянные ампулы, содержащие точную массу вещества, необходимую для приготовления 1 л титрованного раствора. Фиксаналы используются для приготовления первичных стандартных растворов. На фиксанале указывается концентрация раствора и название вещества. Ампулу пробивают с помощью «бойка», помещенного в воронку, над мерной колбой, вначале с одной стороны, затем переворачивают и пробивают с другой стороны. Вещество смывают в мерную колбу, фиксанал промывают шестикратным количеством очищенной воды, промывные воды присоединяют к основному раствору в мерной колбе и доводят объем раствора водой до метки.
К вторичных стандартных растворов рассчитывают как отношение реально полученной концентрации титрованного раствора к теоретически заданной.
С экв (практ.)
К = ---------------------
С экв (теор.)
Согласно ОФС «Титрованные растворы» (ГФ Х1, вып.2, с.61), молярную концентрацию рассчитывают двумя способами.
1. По навеске химически чистого вещества.
а ´ 1000
С экв = ----------------, где
М экв ´ V
С экв – молярная концентрация, моль/л;
а – навеска химически чистого вещества, г;
М экв – молярная масса эквивалентов (условных частиц) химически
чистого вещества, г/моль;
V – объем раствора, пошедшего на титрование навески, мл.
Примечание.
1. Навеска берется с расчетом, чтобы при титровании на нее расходовалось около 20 мл раствора. При таком количестве титранта капельная ошибка составляет 0,1%, если объем капли 0,02 мл.
2. Навеска отвешивается с точностью до 0,0001 г.
3. Определение проводят не менее трех раз. По формуле рассчитывают К. Значения К должны лежать в интервале 0,010. Например: 1,022, 1,028, 1,032. Выпадающие значения отбрасывают, определение повторяют необходимое число раз. Затем находят среднее значение К.
2. По титрованному раствору известной концентрации.
С экв 0 ´ V0
С экв = ---------------, где
V
С экв 0 – молярная концентрация раствора вещества, по которому
устанавливается титр, моль/л;
V0 – объем раствора с известной молярной концентрацией, мл;
V – объем раствора, молярную концентрацию которого
устанавливают, мл.
Примечание.
1. Для определения берут обычно 20 мл раствора (см. выше).
2. Титрование проводят не менее трех раз. Расхождение в значении объемов, пошедших на титрование не должно превышать 0,05 мл. Например: 19,80; 19,83; 19,85 мл. Выпадающие значения отбрасывают, определение повторяют необходимое число раз. Затем находят среднее значение объема, по формуле рассчитывают К.
Приготовление титрованных растворов
1. Приготовление 1 л раствора натрия гидроксида (натра едкого)
(0,1 моль/л)
NaOH + HCl ® NaCl + H2O
f экв (NaOH) = 1; M.м.* NaOH = 40,00
M NaOH ´ C NaOH 40,00 ´ 0,1
Т NaOH (0,1 моль/л) = --------------------- = --------------- = 0,004000 г/мл
1000 1000
а NaOH = Т NaOH ´ V NaOH = 0,004000 ´ 1000 = 4,0 г
Примечание. М.м. – обозначение, принятое ГФ Х1 для относительной молекулярной массы вещества.
Для приготовления раствора берут навеску несколько большую вычисленной, т.к. натрия гидроксид при хранении поглощает углекислоту воздуха и частично переходит в карбонат.
Методика. 4,5 г натрия гидроксида растворяют в 5 мл воды, колбу плотно закрывают пробкой и оставляют до следующего дня. Жидкость сливают с осадка в мерную колбу вместимостью 1 л и доводят свежепрокипяченной и охлажденной водой до метки.
Согласно ГФ Х1 (вып. 2, с. 66), для приготовления используют исходный раствор (160 г натрия гидроксида в 300 мл воды), 8 мл этого раствора помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки.
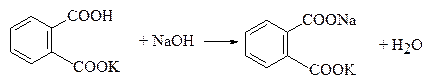 К раствора натрия гидроксида по ГФ Х1 устанавливают по калия гидрофталату (КГФ). В основе определения лежит реакция нейтрализации:
К раствора натрия гидроксида по ГФ Х1 устанавливают по калия гидрофталату (КГФ). В основе определения лежит реакция нейтрализации:
f экв (КГФ) = 1; M.м. КГФ = 204,23
M КГФ ´ C NaOH 204,23 ´ 0,1
Т КГФ/NaOH (0,1 моль/л) = --------------------- = ------------------- = 0,02042 г/мл
1000 1000
Рассчитывают навеску калия гидрофталата, на титрование которой израсходовалось бы 20 мл раствора натрия гидроксида (0,1 моль/л).
а КГФ = ТКГФ ´ VNaOH = 0,02042 ´ 20 = 0,4084 г
Таким образом, для определения К берут навеску около 0,41 г.
Методика. Около 0,41 г (точная навеска) калия гидрофталата, предварительно тонко измельченного и высушенного при температуре 120 0С в течение 2 ч, растворяют в 30 мл воды и титруют приготовленным раствором натрия гидроксида (0,1 моль/л) (индикатор – фенолфталеин).С экв вычисляют по первому способу.
|
|
|


