 |
Изучение кинетики химических реакций
|
|
|
|
Кинетику реакций, протекающих в жидкостях или твердых телах, можно изучить по величине тепловыделения или теплопоглощения на кривых ДТА. Непрерывное измерение выделяемого (поглощаемого) потока тепла по ходу реакции, дает нам величину, пропорциональную скорости реакции. Скорость химических реакций в условиях изотермического режима нагрева является функцией концентрации реагирующих веществ, которая зависит не только от природы веществ, но и от условий проведения опытов, таких, как температура, давление и т.д., и практически может быть определена по быстроте расходования основного реагирующего вещества в единицу времени. Изменение концентрации во время реакции определяется в экспериментальной кинетике по уравнению:
 , (8)
, (8)
где: С – концентрация выбранного убывающего компонента к моменту времени t.
Применительно к методу ДТА кинетические уравнения для изотермических реакций принято записывать в следующем виде:
 ; (9)
; (9)
 . (10)
. (10)
Для n = 1: 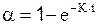 ; (11)
; (11)
 ; (12)
; (12)
для n ¹ 1:  ; (13)
; (13)
 , (14)
, (14)
где:  - скорость реакции, с-1; K – константа скорости, с-1; a - степень превращения, величина, увеличивающаяся с течением реакции от 0 до 1; n – порядок реакции. В практике кинетических расчетов величина n обычно подбирается так, чтобы наилучшим образом можно было описать экспериментальные результаты.
- скорость реакции, с-1; K – константа скорости, с-1; a - степень превращения, величина, увеличивающаяся с течением реакции от 0 до 1; n – порядок реакции. В практике кинетических расчетов величина n обычно подбирается так, чтобы наилучшим образом можно было описать экспериментальные результаты.
Зависимость константы скорости от температуры выражается уравнением Аррениуса:
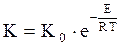 , (15)
, (15)
где: K0 – константа скорости при бесконечно большой температуре; E – энергия активации реакции, кДж/моль; R – универсальная газовая постоянная; T – температура, К.
Расчеты кинетических параметров имеют практическое значение, так как они дают возможность количественного описания хода реакции и могут быть использованы для расчета степени протекания реакции в любой момент времени от начала до конца, определения степени разложения, полимеризации, деполимеризации, твердения полимеров, ферментативных реакциях и т.д.
|
|
|
Определение кинетических параметров химических реакций методом ДТА может осуществляться в изотермическом и неизотермическом режимах нагрева. В изотермическом режиме нагрева, где температура опыта постоянна, скорость химической реакции, т.е. степень превращения, экспериментально определяется по величине тепловыделения (теплопоглощения) в любой момент времени из кривой ДТА. Если заменить степень превращения величиной тепловыделения (теплопоглощения), измеренной на экспериментальной кривой ДТА, то можно записать следующее рабочее уравнение:
 ; (16)
; (16)
 , (17)
, (17)
где: dH/dt – мгновенная скорость тепловыделения, Дж/с, Вт; DHоб – общая энтальпия всей реакции, Дж; DHi – частичная энтальпия реакции, Дж. Для этого надо предварительно проградуировать ординату на кривой ДТА (dH/dt) в Дж/с, Вт. Энтальпии для всей реакции (DHоб) и частичной (DHi) определить (в Дж) через замер соответствующих площадей под кривой ДТА.
Подставляя уравнения (16) и (17) в кинетическое уравнение (9) и прологарифмировав, можно получить:
 . (18)
. (18)
По полученным экспериментальным данным можно построить график в координатах:  от
от  , где по оси y определяем lnK, а по углу наклона к оси x – n.
, где по оси y определяем lnK, а по углу наклона к оси x – n.
Изотермический метод определения кинетических констант имеет определенные трудности, которые заключаются в выборе приема инициирования изучаемой реакции при выбранной постоянной температуре опыта.
Суть неизотермического метода заключается в записи кривой ДТА в условиях линейного повышения температуры. Поскольку неизотермический режим реализуется на практике чаще, в частности, на дериватографах, рассмотрим и этот метод.
Комбинируя уравнения (9) и (15) можно получить:
|
|
|
 . (19)
. (19)
Если теперь заменить степень превращения через величину тепловыделения из экспериментальной кривой ДТА в соответствии с уравнениями (16) и (17), то можно записать:
 , (20)
, (20)
или, если прологарифмировать:
 . (21)
. (21)
Ординату на кривой ДТА надо предварительно проградуировать в dH/dt (в Дж/с, Вт). Величина тепловыделения dH/dt измеряется по длине ординаты ДТА-кривой в точке T. Величины энтальпии DHоб и DHi (в Дж) определяется через величины соответствующих площадей под кривой ДТА.
Для расчета искомых величин K, E, n теоретически необходимы только три температурные точки: T1, T2, T3, взятые на экспериментальной кривой ДТА, описывающей тепловыделение изучаемой реакции в неизотермическом режиме нагрева. В таком случае можно составить три уравнения с тремя неизвестными, т.е. рассчитать K0, E, n.
Порядок реакции n рассчитывается для трех точек по следующему уравнению:
 . (22)
. (22)
По полученным экспериментальным данным можно построить график в координатах:  от
от  , где по оси y определяем lnK0, а по углу наклона к оси x – n.
, где по оси y определяем lnK0, а по углу наклона к оси x – n.
Для процессов растворения, дегидратации и т.д. обычно n = 1, тогда все расчеты упрощаются и возможно для каждой из трех выбранных температурных точек определить Ki по уравнению:
 . (23)
. (23)
Кинетические параметры реакций можно рассчитать по кривым ТГ и ДТГ. По величине известной исходной массы образца и данным потери массы можно определить степень превращения для различных моментов времени.
Методами ДТА, ТГ и ДТГ можно изучать реакции, идущие по типу:
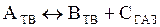 . (24)
. (24)
К таким реакциям принадлежат реакции дегидратации, диссоциации и т.д., кинетика протекания которых находит очень важное применение в минералогии при изучении термического разложения ферритов, цементов, полимеров и т.д.
|
|
|


