 |
Cтроение сопряженных диенов
|
|
|
|
АЛКАДИЕНЫ
Содержание главы:
1. Сопряженные алкадиены (1,3-алкадиены)
2. Cтроение сопряженных диенов
3. Реакционная способность сопряженных диенов
4. Кумулированные алкадиены (аллены)
Диенами называют углеводороды, в молекулах которых имеется два структурных фрагмента с двойными углерод-углеродными связями. Различают три типа диенов: изолированные, сопряженные и куммулированные.

Если между кратными связями в цепи молекулы диена находится хотя бы одна метиленовая группа (СН2), они практически не отличаются по своим свойствам от алкенов и поэтому в данном разделе рассматриваться не будут. Это – так называемые изолированные диены.
Те соединения, в молекулах которых двойные связи разделены одной ординарной связью, называются сопряженными. Они обладают рядом специфических свойств, связанных с сопряжением p-электронных орбиталей.
Кумулированные диены весьма мало изучены, но их строение и свойства представляют значительный интерес.
в начало страницы
Cопряженные алкадиены (1,3-алкадиены)
К наиболее известным представителям сопряженных диенов относятся: бутадиен-1,3 (дивинил), 2-метилбутадиен-1,3 (изопрен), 2-хлорбутадиен-1,3 (хлоропрен).
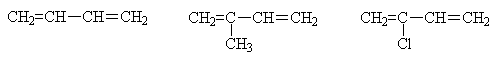
Эти соединения используются в качестве мономеров для промышленного получения различных полимерных материалов, главным образом каучуков. Дивинил получают ступенчатым дегидрированием бутана на оксидном железо-хромовом катализаторе при 550-600 0С.
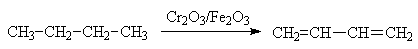
В России Лебедевым был предложен способ получения дивинила из этанола
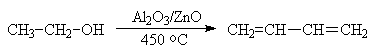
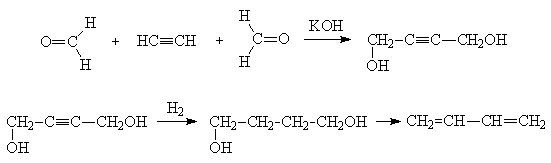
Находит применение способ немецкого химика Реппе, согласно которому бутадиен синтезируют из бис-гидроксиметилацетилена через 1,4-бутандиол:
в начало страницы
|
|
|
Cтроение сопряженных диенов
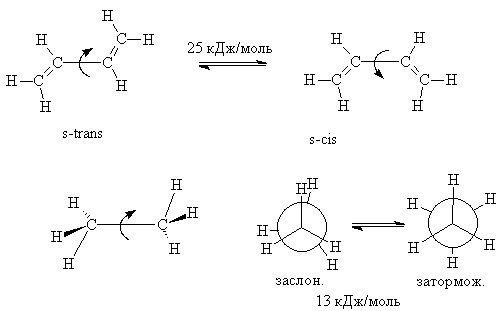
Рассмотрим особенности свойств сопряженных диенов на примере простейшего представителя – бутадиена-1,3. Согласно результатам структурных исследований, молекула бутадиена является плоской, все четыре атома углерода имеют гибридизацию sp2. Она может находиться в форме двух конформаций, обозначаемых s- цис и s- транс (s от английского "single" – одинарный). Конформации различаются взаимным расположением винильных фрагментов относительно ординарной связи, с чем и связано это обозначение. Барьер вращения в бутадиене составляет 25 кДж/моль, т.е. значительно выше, чем в этане (13 кДж/моль), но лишь ненамного превосходит разницу энергий заслоненной и заторможенной конформаций бутана (22,6 кДж/моль). s- цис -Конформация на 25 кДж/моль менее выгодна, чем s- транс.
Чем же обусловлено затрудненное вращение в молекуле бутадиена?
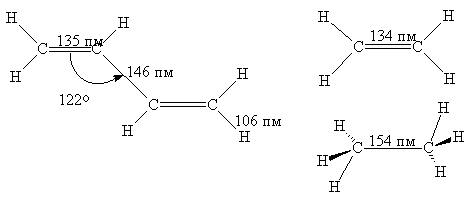
Как показывают структурные исследования, в молекуле 1,3-бутадиена двойные связи (135 пм) несколько длиннее, чем в этилене (134 пм), а ординарная связь С2-С3 (146 пм) короче, чем в этане (154 пм). Это заставляет предполагать, что порядок связей в бутадиене не является целочисленным, т.е. p-электронная плотность частично делокализована с участием четырех С-атомов. Квантово-химические расчеты дают следующие величины порядка p‑связей С1-С2 0,894, и С2-С3 –0,447.
Таким образом, можно говорить о частичной двоесвязности атомов углерода в молекуле: связь С2-С3 несколько больше чем одинарная, а связи С1-С2 и С3-С4 несколько меньше, чем двойные. Это явление, называется сопряжением p-связей. Сопряжение возможно благодаря тому, что p-орбитали, которые эти связи образуют, расположены не на линии между ядрами, а в перпендикулярной плоскости, что допускает их перекрывание во всех направлениях. Другими словами, p-орбиталь атома С2 взаимодействует с орбиталями как атома С1, так и С3.
Делокализацию p-электронов можно изобразить разными способами:
|
|
|
- с помощью набора резонансных структур (следует помнить, что вклад структур с разделенными зарядами в резонансный гибрид обычно меньше, чем тех, в которых заряды не разделены).

- изогнутыми стрелками, показывающими направление смещения электронной плотности, а также частичной двоесвязностью (так называемая мезомерная структура, пунктиром обозначаются связи нецелого порядка)

Обратимся к квантовой химии. В молекуле бутадиена-1,3 имеется четыре молекулярные p-орбитали (p-МО), получаемые в результате линейной комбинации четырех атомных р-орбиталей. Эти p-МО имеют разные энергетические уровни, расчет которых для каждой орбитали может быть сделан посредством решения уравнения Шредингера (Нy = Еy). В этом уравнении волновая функция МО представлена как линейная сумма волновых функций атомных орбиталей с соответствующими коэффициентами.
Y = с1j1 + с2j2 + с3j3 +с4j4
j - некоторая мера вероятности пребывания электрона в объеме пространства,
с- доля участия атомной орбитали в молекулярной орбитали..
Выше было показано использование метода молекулярных орбиталей Хюккеля (МОХ) для молекулы этилена. Применим этот же метод для расчета сопряженной p-системы бутадиена.

| НСМО |
| ВЗМО |
О наличии сопряжения в молекуле бутадиена-1,3 делают вывод на основании того, что энергия его четырех электронов меньше таковой двух изолированных пар p-электронов в дух молекулах этилена, которая, как было показано, равна 2(a + b):
DEp = (4a + 4b) - (4a + 4,472b) = 0,472b
DEp называют энергией сопряжения или энергией резонанса. Эта величина позволяет оценить стабилизацию системы за счет сопряжения (резонанса).
Две орбитали ВЗМО и НСМО называют фронтальными, и они отвечают за реакционную способность соединения: ВЗМО в реакции с электрофилами, НСМО – с нуклеофилами. Одним из убедительных аргументов, подтверждающих явление делокализации в 1,3-диенах и других сопряженных системах считаются данные электронной спектроскопии этих соединений.
Ультрафиолетовая (УФ) или электронная спектроскопия позволяет определить величину кванта энергии, необходимого для перехода электрона с одного энергетического уровня на другой. Для этого измеряется длина волны, при которой происходит наиболее интенсивное поглощение электромагнитного излучения. Переход любой молекулы из стационарного состояния в возбужденное является следствием поглощения энергии. Наименьшая энергия затрачивается при переходе одного электрона с ВЗМО на орбиталь с более высокой энергией (НСМО). Эта энергия квантована, т.е. конкретному переходу электрона соответствует строго определенная ее величина. Последняя, в свою очередь, имеет эквивалент в виде длины волны, при поглощении которой происходит возбуждение молекулы. Молекулы бесцветных веществ переходят в возбужденное состояние под действием весьма высоких энергий, т.е. поглощают в коротковолновой части электромагнитного спектра.. Они занимают область с длинами волн от 100 до 400 нм, что соответствует энергии от 1170 до 293 кДж/моль. Большую энергию поглощают s-связи. Так, lmax (длина волны максимального поглощения) алканов лежит в области более коротких, чем 150 нм, волн. Это может быть зафиксировано лишь в условиях глубокого вакуума, т.к. воздух поглощает при длине волны, меньшей 180 нм. Несколько меньшая энергия требуется для возбуждения алкенов, но их область поглощения тоже закрыта воздухом (lmax гексена-3 184 нм, Е=712 кДж/моль). Соединения же с сопряженными связями поглощают ультрафиолет в доступной для наблюдения части спектра (lmax бутадиена-1,3 217 нм, Е = 540 кДж/моль). С увеличением длины сопряжения максимум поглощения смещается в более длинноволновую область (lmax гексатриена-1,3,5 255 нм, Е = 452 кДж/моль; декатетраена-2,4,6,8 310 нм, Е = 389 кДж/моль). Для того, чтобы понять причины этого явления вернемся к рассмотрению молекулярных орбиталей этилена и сопряженных полиенов.
|
|
|

Легко видеть, что энергия ВЗМО этилена a+b (- 10,88*10-5 кДж/моль) меньше, чем энергия сопряженной системы бутадиена-1,3, которая имеет величину a+0,618b (- 9,43*10-5 кДж/моль). Обратное соотношение имеют энергии НСМО этих молекул. Таким образом, с увеличением длины сопряжения разница энергий НСМО и ВЗМО «DЕ» уменьшается. Это означает: возбуждение сопряженных систем требует меньшую энергию, чем несопряженных. Следовательно, в бутадиене-1,3-имеется сопряжение.
|
|
|

в начало страницы
|
|
|


