 |
Адсорбция уксусной кислоты на поверхности
|
|
|
|
АКТИВИРОВАННОГО УГЛЯ
Цель работы: изучение адсорбции уксусной кислоты на активированном угле, определение величины адсорбции уксусной кислоты.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Адсорбция (от лат. ad-на, при и sorbeo-поглощаю), изменение (обычно -повышение) концентрации вещества вблизи поверхности раздела фаз ("поглощение на поверхности"). В общем случае причина адсорбции это нескомпенсированность межмолекулярных сил вблизи этой поверхности, т.е. наличие адсорбционного силового поля. Тело, создающее такое поле, называется адсорбентом (т.е. вещество которое поглощает).
Вещество, молекулы которого могут адсорбироваться - адсорбтивом, а уже адсорбированное вещество - адсорбатом. Процесс, обратный адсорции, называется десорбцией.
Природа адсорбционных сил может быть различной. Если это ван-дер-ваальсовы силы взаимодействия, то адсорбция называется физической; если адсорбция сопровождается образованием на поверхности химических соединений – то химической адсорбцией, или хемосорбцией. Химическая адсорбция является практически необратимым процессом.
Величиной адсорбции Г – называют отношение числа молей поглощенного вещества к площади адсорбента или отношение числа молей поглощенного вещества к массе адсорбента:
 ,
, 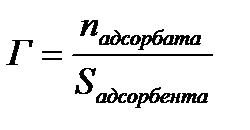
Единицы измерения величины адсорбции – моль/г, моль/м2
Величина адсорбции Г зависит от природы адсорбента (полярный или неполярный адсорбент и т.д.), адсорбтива (ионы, ПАВ и др.) и его концентрации, температуры и давления. Так при постоянной температуре физическая адсорбция увеличивается с ростом давления газа или концентрации раствора. С увеличением температуры физическая адсорбция уменьшается.
|
|
|
График зависимость величины адсорбции Г от концентрации раствора адсорбируемого вещества называется изотермой адсорбции Ленгмюра. Уравнение Ленгмюра:

Где «b» константа зависящая от природы адсорбируемого вещества.
Количественное соотношение между величиной адсорбции Г и изменением поверхностного натяжения определяется уравнением Гиббса:

Адсорбция положительна, когда  , т.е. когда при протекании адсорбции поверхностное натяжение понижается. Отношение
, т.е. когда при протекании адсорбции поверхностное натяжение понижается. Отношение 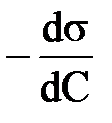 называют поверхностной активностью.
называют поверхностной активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1 этап
1. Подготовьте бюретку – промойте её и залейте 0,1н раствором гидроксида натрия, установите уровень жидкости в бюретки на 0 мл.
2. Установите концентрацию исходной уксусной кислоты. Для этого в три колбы внесите по 10 мл исходной уксусной кислоты и 1-2 капли фенолфталеина, титруйте данные растворы 0,1н раствором гидроксида натрия до появления светло- малиновой окраски. Для каждого титрования уровень в бюретке установите на 0 мл.
3. Концентрацию уксусной кислоты вычислите из формул ы: 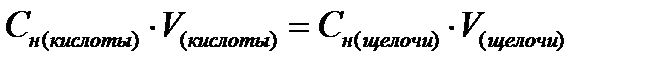
Результаты запишите в таблицу 1.
Таблица 1
Данные титрования до адсорбции
| № колбы | |||
| VNaOH, мл | |||
| VNaOH, мл (среднее) | |||
 до адсорбции, моль/л
до адсорбции, моль/л
|
2 этап
1. На электронных весах взвесьте 1 г активированного угля.
2. В стакан внесите навеску активированного угля, прилейте 50 мл уксусной кислоты заданной концентрации (той, с которой рвботали на 1 этапе) и перемешайте.
3. Через 15 минут в чистую колбу отфильтруйте от угля раствор уксусной кислоты, отмерьте 10 мл фильтрата и перенесите в чистую колбу, добавьте 1-2 капли фенолфталеина и титруйте раствор 0,1н раствором NaOH. Опыт повторите три раза. Для каждого титрования уровень в бюретке установите на 0 мл. Рассчитайте концентрацию уксусной кислоты. Результаты запишите в таблицу 2.
Таблица 2
Данные титрования после адсорбции
|
|
|
| № колбы | |||
| VNaOH, мл | |||
| VNaOH, мл (среднее) | |||
 после адсорбции, моль/л
после адсорбции, моль/л
|
4. Рассчитайте массу уксусной кислоты в 50 мл раствора до адсорбции (m1) и после адсорбции (m2). Для расчетов используйте следующую формулу: 
Данные запишите в таблицу 3.
5. Рассчитайте массу адсорбированной уксусной кислоты:

Данные запишите в таблицу 3.
6. Рассчитайте концентрацию адсорбированной уксусной кислоты:

7. Рассчитайте величину адсорбции:
 , моль/г.
, моль/г.
Объем должен быть выражен в литрах.
8. Данные запишите в таблицу 3.
Таблица 3
Результаты адсорбции уксусной кислоты на активированном угле
| m1, г | m2, г | mадcорб.вещества, г | Садсорб.вещества, г | Г, моль/г |
9. Сделайте вывод о величине адсорбции.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Масса изобутилового спирта до адсорбции составила 46,97 г, после адсорбции -44,89 г. Масса адсорбента – 8,3 г. Рассчитать величину адсорбции (моль/г).
Ответы: 1) 0,0034; 2) 2,08; 3) 0,0281; 4) 0,2506; 5) 0,0042.
2. Найти молярную концентрацию метилового спирта после адсорбции на активированном угле массой 3,8 г, если величина адсорбции составила 0,0024 моль/г. Для определения было взято 45 мл раствора с концентрацией 0,40 моль/л.
Ответы: 1) 0,018; 2) 0,197; 3) 0,00912; 4) 0,00888; 5) 0,20.
3. Гидрофильность-это
Ответы:
1) хорошая смачиваемость водой поверхности твердого тела;
2) свойство твердого тела не смачиваться водой;
3) свойство твердого тела не смачиваться водой; 
4) хорошая смачиваемость водой поверхности твердого тела; 
5) свойство твердого тела не смачиваться любым растворителем. 
4. При растворении в воде неорганической соли KBr
Ответы: 1) адсорбция увеличивается, это поверхностно-активное вещество;
2) адсорбция уменьшается, это поверхностно-активное вещество;
3) адсорбция увеличивается, это поверхностно-инактивное вещество;
4) адсорбция уменьшается, это поверхностно-инактивное вещество;
5) адсорбция не меняется.
Лабораторная работа № 5
КОЛЛОИДНЫЕ РАСТВОРЫ
Цель работы: составление реакций мицеллообразования, рассмотрения влияния неорганических ионов на процесс коагуляции.
- ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Коллоидные системы по размерам частиц дисперсной фазы занимают промежуточное положение между истинными растворами (более 10-9м) и грубодисперсными системами (10-5-10-6м). Они могут быть получены двумя путями: конденсацией молекул или ионов (метод конденсации) и дроблением более крупных частиц до нужной степени дисперсности (метод диспергирования). Известны также случаи самопроизвольного диспергирования дисперсной фазы в дисперсной среде.
|
|
|
Для придания частицам устойчивости против слипания (агрегативной устойчивости) необходимо создание на поверхности частиц защитных слоев: двойных ионных слоев, вызывающих электростатическое отталкивание (электростатический фактор устойчивости), и сольватных, или адсорбционно - сольватных слоев, препятствующих в силу своих особых структурно -механических свойств соприкосновению и слипанию частиц (структурно - механический фактор стабилизации).
|
|
|


