 |
Порог коагуляции - минимальное количество электролита вызывающего начало коагуляции.
|
|
|
|
Пример: порог коагуляции для некоторых электролитов, вызывающих коагуляцию отрицательно заряженного золя As2S3:
Таблица 1.
| электролит | LiCl | NaCl | MgCl2 | BaCl2 | AlCl3 |
| Концентрация ммоль/л | 0,71 | 0,69 | 0,09 |
Правило Шульце ( 1882 г.) – порог коагуляции резко уменьшается при увеличении степени окисления коагулирующих ионов (таблица 1), порог коагуляции двухвалентных катионов (Mg2+ , Ca2+) в несколько десятков раз ниже, чем для одновалентных; для трехвалентных катионов порог коагуляции ниже в сотни раз по отношению к одновалентным ионам. То же правило относится и к анионам, вызывающим коагуляцию.
Правило размеров коагулирующих ионов – при одинаковой валентности коагулирующая способность увеличивается с увеличением их атомного радиуса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Получение золя фосфата железа
В пробирку внесите 15-20 капель фосфата натрия и аккуратно прилейте 1- 2 капли хлорида железа. На поверхности образуется желтый флюоресцирующий золь фосфата железа. Раствор встряхните, в пробирке видно хаотичное движение коллоидных частиц (броуновское движение).
Опыт повторите, взяв в избытке хлорид железа и прибавив 1-2 капли фосфата натрия. Напишите уравнение реакции и формулы образующихся мицелл в первом и во втором случае.
Опыт 2 Получение геля кремневой кислоты
В пробирку внесите 5-6 капель силиката натрия и несколько капель серной кислоты. В пробирке наблюдается образование белого студенистого осадка. Напишите уравнение реакции и формулу образующейся мицеллы, учитывая, что на поверхности ядра протекает адсорбция силикат-ионов.
Опыт 3. Коагуляция гидрозоля гидроксида железа электролитом
Гидрозоль гидроксида железа получают методом конденсации при протекании реакции гидролиза хлорида железа при 100°С, при данной температуре можно считать, что реакция гидролиза протекает полностью (по всем трем ступеням):
|
|
|
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
Напишите формулу образующейся мицеллы, учитывая, что на поверхности ядра протекает адсорбция ионов Fe 3+.
В 3 подписанные пробирки внесите по 5 мл гидрозоля железа, затем в две пустые пробирки внесите по 2 мл раствора сульфата натрия, в одну – 0,01 М, в другую - 0,02 М.
Контрольную пробирку 1 (к) оставьте для сравнения, затем одновременно прилейте в пробирки с гидрозолем железа содержимое пробирок с сульфатом натрия: в пробирку № 2 - 2 мл раствора сульфата натрия 0,01 М, в пробирку № 3 - 2 мл сульфата натрия 0,02 М. Засеките время до начала помутнения раствора. Результаты занести в таблицу.
| № пробирки | Концентрация электролита сульфата натрия, м/л | Время до начала помутнения, мин. |
| 1(к) | ||
| 0,01 | ||
| 0,02 |
Сделайте вывод, какое количество электролита более эффективно вызывает коагуляцию.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какой из перечисленных ионов обладает более сильным коагулирующим действием, если ион мицеллы является анионом?
Ответы: 1) AsO 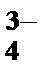 , 2) Cr3+, 3) Fe2+, 4) Cd2+, 5) SO
, 2) Cr3+, 3) Fe2+, 4) Cd2+, 5) SO  .
.
2. Какой из перечисленных ионов обладает более сильным коагулирующим действием, если ион мицеллы является катионом?
Ответы: 1) MnO 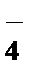 , 2) Na+, 3) Fe3+, 4) ClO
, 2) Na+, 3) Fe3+, 4) ClO 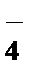 , 5) K+.
, 5) K+.
3. Какие частицы составляют слой противоионов данной мицеллы:
[m(AgI) ·nAg+·(n-x)NO3¯]x+·xNO3¯
Ответы:
1. m(AgI)
2. m(AgI) ·nAg+
3. (n-x)NO3¯xNO3¯
4. nAg+·(n-x)NO3¯
4. Каким будет заряд коллоидной частицы, образованной при взаимодействии хлорида бария (в избытке) и карбонат натрия, и к какому электроду (аноду или катоду) она будет двигаться?
Ответы:
1. +2х, к катоду
2. -2х, к аноду
3. +2х, к аноду
4. -2х, к катоду
5. нейтральный, не перемещается
5. Какие вещества используют для придания устойчивости коллоидному раствору?
|
|
|
Ответы:
1. Адсорбенты
2. Индикаторы
3. Коагуляторы
4. Стабилизаторы
5. Адсорбаты
Терминология:
| Абсорбция | |
| Агрегативная устойчивость | |
| Адсорбат | |
| Адсорбент | |
| Адсорбтив | |
| Адсорбция | |
| Аэрозоли | |
| Гель | |
| Гидрозоли | |
| Деэмульгаторы | |
| Диспергирование | |
| Дисперсная система | |
| Диффузия | |
| Золь | |
| Кинетическая устойчивость | |
| Коагуляция | |
| Коалесценция | |
| Коллоидный раствор | |
| Лиозоли | |
| Лиотропные ряды | |
| Лиофильные системы | |
| Лиофобные системы | |
| Мицелла | |
| Осмос | |
| ПАВ | |
| Пептизация | |
| Порог коагуляции | |
| Седиментация | |
| Сорбция | |
| Стабилизаторы (эмульгаторы) | |
| Суспензии | |
| Электрофорез | |
| Эмульсии |
Лабораторная работа №6
|
|
|


