 |
Он нужен всей стране родной.
|
|
|
|
(Ответ: Железо)
После чего тема урока не оставалась секретом.
Тема урока демонстрируется слайдом №2. После чего учащиеся знакомятся с целью урока, его задачами.
На втором этапе урока (объяснение нового материала) учащиеся должны были заполнить «Визитную карточку железа». Работая в паре определите адрес «проживания» железа (5 мин) по следующему плану: Где расположено железо в ПС? Каково строение его атома? Какую степень окисления следует ожидать у железа в его соединениях?
На экране появляются соответствующие пункты, учащиеся отвечают, записывают ответы в свои тетради, после чего на экране появляются правильные ответы (Слайд №3):
Порядковый номер: 26
Период: IV
Группа: VIII
Электронная формула атома: 1s22s22p63s23p63d64s2
Степень окисления: +2, +3
Далее учитель зачитывает высказывание А. Е. Ферсмана с экрана (слайд №4):
«Железо не только основа всего мира, самый главный металл окружающей нас природы, оно - основа культуры и промышленности, оно - орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества».
И задает ребятам вопросы «Как вы думаете, ребята, почему Ферсман дал такую высокую оценку железу? Вспомните, где этот металл находит применение?» Дети называют области использования железа, учитель дополняет:
Действительно, применение железа насчитывает уже много столетий, но настоящее вторжение железа в технику произошло на рубеже XVIII и XIX веков.
|
|
|
Из сплавов, в состав которых входит железо, изготовляется плуг земледельца, станок рабочего, оружие воина, стоящего на страже мирного труда, игла, которой вы шьете. Без железа немыслима ни одна отрасль современной промышленности: кораблестроение, строительство железных дорог, машиностроение, строительное дело, военное дело. Не будь его, на Земле не было бы жизни в привычных для нас формах: ведь этот элемент входит в состав крови почти всех представителей животного мира нашей планеты. Железо необходимо для образования хлорофилла. Железо, содержащееся в ферментах, в значительной степени влияет на интенсивность дыхания растений. В организме человека железо встречается в виде ионов железа. Оно входит в состав гемоглобина, который переносит кислород к клеткам, а обратно – углекислый газ. Обычно содержание железа в организме не превышает 5 г, но его значение очень велико. При недостатке железа в организме человек быстро начинает утомляться, возникают головные боли, появляется плохое настроение. И для человека, а также животных источником железа являются растения, например, салат, шпинат, капуста.
(При этом демонстрируется слайд №5, в котором отображены основные отрасли применения железа).
На данном этапе урокавыступает ученик с сообщением «Нахождение железа в природе» (Слайд №6), содержание которого следующее:
Первое железо, попавшее еще в глубокой древности в руки наших предков, было, по-видимому, не земного, а космического происхождения. Железо входит в состав метеоритов, падающих на нашу планету из космического пространства. Не случайно на некоторых древних языках железо именуется «небесным камнем». Железо также обнаружено и на Луне, причем в лунном грунте оно присутствует в самородном, неокисленном состоянии, что, очевидно, объясняется отсутствием атмосферы.
По запасам в земной коре железо занимает 4-е место среди вех элементов после кислорода, кремния и алюминия. Намного больше железа в ядре планет, которое, по предложениям ученых, состоит из никеля и железа. Но это железо вряд ли станет доступным в обозримом будущем. В связи с этим важнейшим источником железа остаются залегающие на поверхности земли или небольших глубинах такие минералы, как магнетит Fe2O4, гематит Fe2O3, сидерит FeCO3.
|
|
|
(Демонстрируется слайд №7 с фотографиями основных минералов железа).
Они составляют основу главных железных руд – магнитного, бурого, красного железняка. Больше всего железа – 72,4% - содержится в магнетите.
(Демонстрируется слайд №8 с диаграммой, отражающей содержание железа в минералах).
На территории Мордовии (Ельниковкий, Краснослободский районы) есть месторождения железной руды, но они слабо изучены.
(Демонстрируется слайд №9 - карта с отображением расположения перечисленных районов на территории республики Мордовия).
Далее речь ведется о физических свойствах: железо – серебристо-белый блестящий металл (tпл=1539 C, tкип=3200 C), обладающий ферромагнитными свойствами, довольно тяжелый (ρ =7,87 г/см3). Железо пластично, т.е. ему можно придавать большую прочность и твердость за счет термического и механического воздействия (закалка, прокатка).
Существует железо технически чистое и особой чистоты. Разница в их свойствах – и физических, и химических – значительна. Технически чистое железо называется низкоуглеродистой электротехнической сталью. В этом названии отражены назначение материала и содержание главных примесей: углерода 0,02-0,04%, а кислорода, серы, азота и фосфора еще меньше.
Железо особой чистоты содержит менее 0,001% примесей.
Оба материала обладают хорошими магнитными свойствами, хорошо свариваются. Однако если технически чистое железо – металл средней активности, то высокочистое – почти – инертно. У железа высшей чистоты прочность намного меньше, чем у стали или чугуна. Поэтому в качестве конструкционного материала железо особой чистоты не применяется. Но если в него ввести в определенном порядке легирующие добавки, то оно сможет выдержать нагрузку до 600 кг/см2 вместо обычных 17-21 кг/см2.
(Демонстрируется слайд №10, в котором отражена опорная схема «Физические свойства железа»).
|
|
|
По ходу рассказа учащиеся должны записать физические свойства железа по следующему плану:
Цвет: серебристо-белый
Твердость: твердый из-за примесей
Пластичность: пластичный
Плотность: 7,87 г/см3
Температура плавления: 1539 0С
Далее на экране появляется следующий пункт – химические свойстважелеза. Учитель задает вопрос: С какими веществами будет реагировать данный металл?
Демонстрируется слайд №11 с опорной схемой.
Работая в парах, учащиеся должны предсказать, какие химические свойства будет проявлять железо?
Учитель просит ребят составить уравнения в соответствии со схемой превращений:
 |
|
| |||
| |||
Учащиеся работают и в тетрадях, и у доски.
Учащиеся переносят полученную схему в тетради. И записывают уравнения реакций, комментируя при этом по цепочке запись соответствующего уравнения реакции, расстановку коэффициентов. Затем проверяют правильность записей (Слайд №12), при этом учитель дополняет их ответ:
Таблица 2.2 – Химические свойства железа
| Без нагревания | При нагревании |
| С кислородом во влажном воздухе образуется Fe2O3 • nH2O | С кислородом 3Fe +2O2=Fe2O3 • FeO |
| C разбавленными HСl и H2SO4 Fe +2 HCl = FeCl2 + H2 Fe0 + 2H+ = Fe2+ + H20 С HNO3 (конц.) и H2SO4 (конц.) не реагирует | C хлором 2Fe +3Cl2=2FeCl3 C серой Fe +S= FeS |
| С солями Fe +CuCl2 = FeCl2 + Cu Fe0 + Cu2+ = Fe2+ +Cu0 | С водой 3Fe +4H2O = Fe3O4 + 4H2 C HNO3 (конц.) и H2SO4 (конц.) реагирует |
Далее учитель сообщает, что чистое железо получают в сравнительно небольших количествах электролизом водных растворов его солей или восстановлением водородом его оксидов. Получает развитие производство железа прямым восстановлением его из рудных концентратов водородом, природным газом или углем при относительно низких температурах.
Учитель предлагает написать уравнения реакций данных процессов и составить окислительно-восстановительный баланс. При этом на экране появляется соответствующий пункт (Слайд №13):
|
|
|
•Fe3O4 + CO =? +?
•FeO + C =? +?
•FeO + H2 =? +?
•Fe2O3 + Al =? +?
Учащиеся работают и в тетрадях, и у доски.
Далее учитель сообщает, что целые страницы, посвященные химии и химической технологии, находим мы в произведениях Ж. Верна. Благодаря химическим знаниям инженера Сайруса Смита («Таинственный остров») было изготовлено много полезных вещей. Первое и главное, что стали делать люди, оказавшиеся на необитаемом острове, - это добывать металл. Для получения чистого металла Смит нагревал при высокой температуре железную руду (магнитный железняк) с углем.
Несколько слов об авторе романа. Французский писатель Жюль Верн (1829-1908) в 1849 г. получает диплом доктора права. Его не прельщает деятельность юриста, т.к. он хочет стать писателем.
Первый приключенческий роман Жюль Верн написал в 35 лет. Чем для нас, химиков, интересны его романы? В них в увлекательной форме описаны многие химические процессы. У писателя была картотека с описанием химических явлений и в личной библиотеке – книга Д.И. Менделеева «Основы химии». Самостоятельное изучение закономерностей химических явлений помогло писателю создать интересные научно-фантастические романы. Он жил во времена расцвета химии и деятельности таких великих ученых, как Д. И. Менделеев, А. М. Бутлеров. Его другом был французский химик П.-Э.Лекок де Буабодран, открывший галлий, предсказанный Менделеевым.
(Демонстрируется слайд №14 с фотографиями писателя и ученых, краткой биографией).
На следующем этапе (закрепление) учащиеся отвечают на вопросы (Слайд №15):
· Какие металлы наиболее распространены в земной коре? (Al, Fe)
· Есть ли в Мордовии залежи железной руды? Почему они мало изучены? (Да, есть. В Ельниковском, Краснослободском районах, но они не используются, так как эти месторождения мало изучены, и руда в них содержит небольшой процент железа.)
· Железо в поэмах Гомера названо «многотрудным металлом». Почему его так называли? (В древние времена добывание железа требовало больших затрат труда. Кроме того, железо труднее поддается плавке, чем медь)
· Где железо ржавеет быстрее: в Ялте, в Москве, в поселке Зубова Поляна? (В Москве, так как в городе много заводов, которые выделяют газы, способствующие тому, что на железе очень скоро появляется ржавчина.)
· Как удалить ржавое пятно с белой ткани? (При помощи лимонной кислоты. Для этого концентрированный раствор этой кислоты нагревают до кипения и опускают в него ткань на 5-6 мин, выжимают и прополаскивают в воде, а затем в слабом растворе соды.)
· Одинаковы ли понятия железо и жесть? (Железо, покрытое оловом, называется жестью, оно более устойчиво, чем железо.)
|
|
|
· Как доказать с помощью опыта, что железо более активно, чем медь? (В пробирку с раствором соли меди опускают железный гвоздь.)
(Демонстрируется слайд №16 с видеофрагментом – взаимодействие железа с хлоридом меди (II)).
Далее учащиеся выполняют самостоятельную работу по вариантам (слайд №17):
Для I варианта:

Для II варианта:
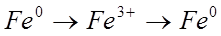
В конце урока учитель предлагает поделиться впечатлениями от урока по следующим пунктам (слайд №18):
Я - насколько активно принимал участие на уроке, мой вклад в работу, каковы мои знания по теме.
Мы – насколько сплоченно работали, все ли удалось на уроке.
Дело - какие знания по изученной теме помогли на уроке, что нужно повторить, какие умения необходимо отработать.
Ребята высказывают свою точку зрения.
В качестве домашнего задания предлагался соответствующий параграф.
Учитель подводит итоги.
|
|
|


