 |
Молекулярная масса (в а.е.м.): 337,26
|
|
|
|
Обнаружение барбитала
1. Барбитал с изопропиламином и солями кобальта дает фиолетовую окраску.
2. От прибавления солей кобальта и щелочей к барбиталу появляется розовая или красная окраска.
3. Барбитал дает мурексидную реакцию.
4. После прибавления серной кислоты к барбиталу образуется кислотная форма этого препарата. Под микроскопом наблюдается появление бесцветных прозрачных прямоугольных призм. Предел обнаружения: 80 мкг барбитала в пробе.
5. При взаимодействии барбитала с раствором хлорцинкиода образуются темно-красные, фиолетовые или серовато-розовые прямоугольные пластинки. Предел обнаружения: 4 мкг барбитала в пробе.
6. Барбитал с солями меди и пиридином образует фиолетовые кристаллы, имеющие форму прямоугольников, друз или звездочек. Предел обнаружения: 14 мкг барбитала в пробе.
Выполнение перечисленных реакций описано выше
Фенобарбитал (люминал) -5-фенил-5-этилбар-битуровая кислота — белый кристаллический порошок слабогорького вкуса, растворяется в этиловом спирте (1: 15), хлороформе (1: 50), в растворах щелочей, слабо растворяется в воде (1: 1000).

Фенобарбитал экстрагируется органическими растворителями из кислых водных растворов.
Применение. Действие на организм. Фенобарбитал оказывает снотворное, успокаивающее и противосудорожное действие. Он применяется для лечения эпилепсии, хореи и других заболеваний. В малых дозах фенобарбитал применяется при начальных стадиях гипертонической болезни, стенокардии и др. Фенобарбитал, по сравнению с другими барбитуратами, относительно медленно всасывается из пищевого канала и имеет продолжительное действие.
Метаболизм. Фенобарбитал метаболизируется несколькими путями. Основными метаболитами фенобарбитала являются 5-этил-5- п -гидроксифенилбарбитуровая кислота, п -оксифенилбарбитал. Эти метаболиты частично выделяются с мочой в виде глюкуронидов. Некоторое количество фенобарбитала превращается в о -оксифенобарбитал. Обнаружены еще 3 метаболита фенобарбитала, состав которых не изучен. Часть принятой дозы фенобарбитала выделяется с мочой в неизмененном виде.
|
|
|
Обнаружение фенобарбитала
1. При взаимодействии фенобарбитала с изопропиламином и солями кобальта появляется фиолетовая окраска.
2. Фенобарбитал с солями кобальта и щелочью дает розовую или красную окраску.
3. Фенобарбитал можно обнаружить при помощи реакции образования мурексида.
4. От прибавления концентрированной серной кислоты к фенобарбиталу образуется кристаллический осадок кислотной формы этого препарата (бесцветные игольчатые кристаллы, сростки из них, сфероиды). Предел обнаружения: 41 мкг фенобарбитала в пробе.
5. Фенобарбитал со смесью соли железа (III) и иодида калия образует оранжево-коричневые или коричневые кристаллы (призмы и их сростки). Предел обнаружения: 4 мкг фенобарбитала в пробе.
Способы выполнения перечисленных реакций приведены выше (см. гл. V, § 12).
6. Реакция образования п-нитрофенилэтилбарбитуровой кислоты. Небольшое количество вещества растворяют в 3 мл концентрированнойсерной кислоты. К этому раствору прибавляют 0,5 г нитрата калия и нагревают в течение 10 мин на кипящей водяной бане. Затем жидкостьохлаждают и прибавляют 10 мл воды. При наличии фенобарбитала образуется кристаллический осадок /г-нитрофенилэтилбарбитуровой кислоты. Осадок отфильтровывают и перекристаллизовывают из этилового спирта. Высущенный осадок имеет температуру плавления 279 °С. Нитрогруппу в /г-нитрофенилэтилбарбитуровой кислоте можно восстановить в аминогруппу, а затем п -аминофенилэтилбарбитуровую кислоту можно обнаружить при помощи реакции диазотирования. Эта реакция специфична для фенобарбитала, но малочувствительна. Ее можно использовать для обнаружения фенобарбитала в порошках, таблетках и др. Эту реакцию дает и бензонал. Ее не дают барбитураты, не содержащие фенильной группы.
|
|
|
Тиами́н (витамин B1; старое название — аневрин) — водорастворимый витамин, соединение, отвечающее формуле C12H17N4OS. Бесцветное кристаллическое вещество, хорошо растворимое в воде, нерастворимое в спирте. Разрушается при нагревании.
Известный как витамин B1 тиамин играет важную роль в процессах метаболизма углеводов и жиров. Вещество необходимо для нормального протекания процессов роста и развития и помогает поддерживать надлежащую работу сердца, нервной и пищеварительной систем. Тиамин, являясь водорастворимым соединением, не запасается в организме и не обладает токсическими свойствами.
Тиамина гидрохлорид

Синонимы:
аневрин
витамин B1
оризанин
торулин
Внешний вид:
бесцветн. кристаллы
Брутто-формула (система Хилла): C12H18Cl2N4OS
Молекулярная масса (в а.е.м.): 337,26
Температура плавления (в °C): 250
Растворимость (в г/100 г или характеристика):
ацетон: трудно растворим
вода: 100 (25°C)
диэтиловый эфир: не растворим
этанол: 0,3 (20°C)
Аналитические
50 мл гиамина хлорида растворяют в 25 мл воды. К 5 мл раствора приливают 1 мл растворагексацианоферрата (III) калия (или перманганата калия, или перекиси водорода), 1 мл раствора едкого натра, 5 мл бутилового или изоамилового спирта. Хорошо встряхивают и дают отстоятся. В верхнем слое возникает наблюдаемая в УФ-свете синяя флуоресценция, исчезающая при подкислении и вновь возникающая при подщелачивании раствора (флюоресценция тиохрома).

ФЕНОКСАЗИН (дибензо-1,4-оксазин), мол.м. 183,2; бесцв. кристаллы; т. пл. 156-159 0C; m 6,1·10-30 Кл·м. Хорошо раств. в ацетоне, диэтиловом эфире, хлороформе, не раств. в воде. Р-ры феноксазина в орг. р-рителях имеют фиолетово-красную флуоресценцию. Молекула слегка непланарна.

Феноксазин обладает св-вами ароматических соединений.
Электроф. замещение протекает легко и направляется в первую очередь в положения 3 и 7 (нитрование, бромирование) или 2 и 8 (р-ция Фриделя - Крафтса); легко также идет N-ацилирование и N-цианоэтилирование.
|
|
|
Алкилирование происходит только в присут. NaNH2. Феноксазин при действии окислителей (FeCl3, Br2, H2O2) в кислой среде (CH3COOH, H2SO4, HClO4) дает соли, окрашенные в оранжевый цвет, к-рые при обработке щелочами превращаются в 3(ЗH)-феноксазинон:

Получают феноксазин нагреванием о-аминофенола с его гидрохлоридом или пирокатехином в присут. кислых катализаторов, а также нагреванием (270 0C) о-аминофенола с I2 (выход 30-35%):

Другой способ получения - внутримол. циклизация 2,2'-ди-замещенных дифенилового эфира при натр, с разл. конденсирующими агентами:
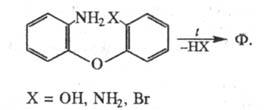
Феноксазин- структурный фрагмент антибиотиков группы актино-мицина; производные феноксазина- синтетич. красители (см. Оксази-новыекрасители).
Оксазины
такие химические соединения, строение (см.) которых представляется в форме кольца, состоящего из 4 атомов углерода, 1 атома азота и 1 атома кислорода, следовательно, они принадлежат к разряду гетероциклических соединений, т. е. таких соединений, кольца которых построены из атомов различных элементов. Представив себе оксазинное кольцо, легко видеть, что в зависимости от взаимного расположения разнородных атомов могут существовать три изомерных группировки. 1) Когда атомы азота и кислорода находятся рядом (орто-О.), 2) когда эти атомы разделены одним атомом углерода (мета-О.) и 3) когда они разделены двумя атомами углерода (пара-О.). Все три ряда этих соединений известны; наибольшее значение имеют только пара-О., так как, с одной стороны, простейший их представитель, морфолин, по-видимому, является ядром, характеризующим группу морфина и его аналогов, с другой же стороны пара-оксазинная группировка характеризует некоторые важные классы искусственных пигментов. Как известно, кольчатые соединения вообще можно разделить на соединения с непрочным ядром, приближающиеся по своим свойствам к жирным, и на соединения с прочными ядрами, типическими представителями которых являются бензольные производные. Эти две группы не резко разграничены между собой и известно много переходных ступеней, к которым, между прочим, нужно причислить и О., в которых относительная прочность ядра до некоторой степени может быть поставлена в зависимость от взаимного расположения гетерогенных атомов. Можно принять, что в этом случае ядро будет тем прочнее, чем дальше удалены друг от друга атомы азота и кислорода. Так орто-О. имеют настолько непрочное кольцо, что более известны под названием ангидридов ортооксимкарбоновых кислот и, в смысле способности образовывать незамкнутые соединения, весьма напоминают γ-лактоны (см.) жирного ряда. Кроме того, ангидриды ортобензальдоксимкарбоновых кислот уже при простом нагревании переходят с большим выделением тепла в изомерные им имиды (см.) ортодикарбоновых кислот:  дает
дает  . Вероятно, сами орто-О. оказались бы имеющими более прочное кольцо, но, к сожалению, они до сих пор не получены и об этом ряде соединений мы можем судить по единственным его представителям, ангидридам оксимкарбоновых кислот, в которых крайняя непрочность ядра отчасти, конечно, зависит и от накопления отрицательных радикалов. Мета-О. вообще представляют более прочные циклические соединения и, хотя простейший их представитель метилфенпентоксазол и разлагается даже при стоянии водного раствора его солей при обыкновенной температуре, тем не менее, другие известные мета-оксазинные производные разрывают свое гетерогенное кольцо только от действия сильных восстановителей (амальгамы натрия в водном или спиртовом растворе). Пара-О. можно разделить на два класса: 1) ядра которых не имеют двойных связей и 2) ядра которых имеют одну или несколько двойных связей. Первый класс по прочности ядер весьма напоминает замкнутые жирные имиды или гидропиридиновые основания, так тетрагидро-О. (морфолин) весьма близок по свойствам к пиперидину. Соединения второго класса по прочности колец значительно превосходят мета-О. и в этом отношении весьма приближаются к бензолу и его производным. Вообще здесь наблюдается, по-видимому, более или менее общее правило, по которому ядро становится тем прочнее, чем больше в нем двойных связей. Что касается химического характера О., то и здесь есть некоторая законность, а именно: чем дальше друг от друга расположены атомы N и О, тем соединения имеют более щелочной характер. Орто-О. индифферентны, мета-О., судя по простейшему представителю метилфенпентоксазолу
. Вероятно, сами орто-О. оказались бы имеющими более прочное кольцо, но, к сожалению, они до сих пор не получены и об этом ряде соединений мы можем судить по единственным его представителям, ангидридам оксимкарбоновых кислот, в которых крайняя непрочность ядра отчасти, конечно, зависит и от накопления отрицательных радикалов. Мета-О. вообще представляют более прочные циклические соединения и, хотя простейший их представитель метилфенпентоксазол и разлагается даже при стоянии водного раствора его солей при обыкновенной температуре, тем не менее, другие известные мета-оксазинные производные разрывают свое гетерогенное кольцо только от действия сильных восстановителей (амальгамы натрия в водном или спиртовом растворе). Пара-О. можно разделить на два класса: 1) ядра которых не имеют двойных связей и 2) ядра которых имеют одну или несколько двойных связей. Первый класс по прочности ядер весьма напоминает замкнутые жирные имиды или гидропиридиновые основания, так тетрагидро-О. (морфолин) весьма близок по свойствам к пиперидину. Соединения второго класса по прочности колец значительно превосходят мета-О. и в этом отношении весьма приближаются к бензолу и его производным. Вообще здесь наблюдается, по-видимому, более или менее общее правило, по которому ядро становится тем прочнее, чем больше в нем двойных связей. Что касается химического характера О., то и здесь есть некоторая законность, а именно: чем дальше друг от друга расположены атомы N и О, тем соединения имеют более щелочной характер. Орто-О. индифферентны, мета-О., судя по простейшему представителю метилфенпентоксазолу  , слабые основания, а все пара-оксазины обладают вполне щелочным характером и только сильно окисленные феноксазоны или феноксазамы индифферентны. Образуются орто-О. при действии гидроксиламина в спиртовом растворе на γ-альдегидо— или γ-кетокислоты; особенно гладко проходит эта реакция с ароматическими ортоальдегидо— или ортокетокислотами; типический представитель этого ряда соединений, бензортооксазинон, и получается по этой реакции:
, слабые основания, а все пара-оксазины обладают вполне щелочным характером и только сильно окисленные феноксазоны или феноксазамы индифферентны. Образуются орто-О. при действии гидроксиламина в спиртовом растворе на γ-альдегидо— или γ-кетокислоты; особенно гладко проходит эта реакция с ароматическими ортоальдегидо— или ортокетокислотами; типический представитель этого ряда соединений, бензортооксазинон, и получается по этой реакции:
|
|
|
|
|
|

.
Мета-О. в зависимости от вида образующихся соединений получаются по трем реакциям: 1) отщеплением HBr от γ-бромалкиламидов кислот, получаются пентоксазодины:

2) При действии на ортоаминобензилгалоидные производные ангидридами кислот получаются фенпентоксазолы и кумазоновые кислоты:
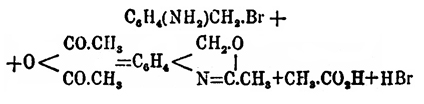
и 3) при действии CS2 на ортоамидобензильный спирт и его гомологи получаются тиокумазоны:

Для пара-О имеется также несколько способов получения: 1) тетрагидропара-О. или морфолин и его гомологи образуются отнятием воды от соответствующих оксэтиламиновых производных: NH:(СН2.СН2ОН)2 — Н2О = NH:(СН2СН2)2:О; 2) конденсацией ортоамидофенола с многоатомными фенолами, ортооксихинонами, ортооксихинонимидами, нитрозофенолами или нитрозодиметиланилином. При этих реакциях получаются или производные феноксазина C6H4:(NO):C6H4, или же производные не полученного еще феноксазона O:C6H3:(NO):C6H4. Последние соединения имеют большое значение в технике, так как многие из них представляют хорошие не субстантивные пигменты (окрашивают только протравленную ткань). К наиболее употребительным пигментам этого класса нужно причислить резоруфин O:C6Н3:(NO):С6Н3(OH), получающийся конденсацией нитрозорезорсина с резорсином, галлоцианин (CH3)2N.C6O3:(NO):C6H(OH)(CO2H): O. получающийся конденсацией нитрозодиметиланилина с галловой кислотой, нафталиновый голубой, образующийся из β-нафтола и нитрозодиметиланилина, нильский голубой, амидопроизводное нафталинового голубого и его анилидопроизводное, известное под именем цианамина.
|
|
|


