 |
Основные требования, предъявляемые к методам определения активности ферментов в почве
|
|
|
|
Почва является сложной гетерогенной системой, в которой большинство биохимических реакций происходят на интерфазе жидкого, твердого и газообразных компонентов. Это создает много методологических проблем при изучении почвенных ферментов. Главная методологическая трудность заключается в необходимости отделения внутриклеточной активности функционально активных микроорганизмов от изучаемой внеклеточной ферментативной активности почвы. Другая трудность заключается в том, что так как почва является сильным адсорбентом, некоторые субстраты и продукты их ферментативной реакции могут сорбироваться почвенными компонентами. Это приводит к искажению результатов их количественного измерения. Поэтому в каждом конкретном случае необходимо это принимать во внимание при выборе субстрата и экстрагентов продуктов реакции.[25]
Активность ферментов максимальна в верхних наиболее биогенных почвенных горизонтах и вниз по почвенному профилю падает, что связано с уменьшением запасов органического вещества, меньшим количеством животных, микроорганизмов, корней растений в нижних горизонтах.[27]
Инактивация деятельности микроорганизмов в почвенных пробах. Ферметативную активность почвы определяют в присутствии почвенных микроорганизмов в реакционной среде. Современные методы почвенной энзимологии дают общую характеристику активности почвенных ферментов, присутствующих в почве вне клеток живых организмов (свободные внеклеточные ферменты и внутриклеточные ферменты, связанные с фрагментами разрушающихся мёртвых клеток микроорганизмов и тканей растений), и ферментов, которые могут выделяться живыми микроорганизмами в процессе определения ферментативной активности почвы в результате неполного ингибирования. Отсюда вытекает главная методологическая проблема почвенной энзимологии: провести эффективную инактивацию роста и физиологических процессов микроорганизмов в почвенной пробе, чтобы предотвратить выделение новых ферментов и в то же время оставить почвенные ферменты неизменёнными и не нарушить химические и физические свойства почвы, что может привести к изменению их активности.
|
|
|
Основное требование к инактиваторам: они не должны разрушать клетки микроорганизмов (плазмолиз) и изменять проницаемость клеточных оболочек для ферментов, субстрата и продуктов реакции. Эффективная инактивация жизнедеятельности микроорганизмов предотвращает поступление в почву дополнительных количеств ферментов, утилизацию субстрата и продуктов реакции микроорганизмами, которые могут значительно исказить истинные значения показателей ферментативной активности исследуемой почвы.
Определение ферментативной активности может дать надёжный результат только в том случае, если концентрация субстрата не снижается в результате обстоятельств, не связанных с ферментативным превращением его, и если концентрация продуктов, образующихся из субстрата под воздействием ферментов, не изменяется вследствие процессов, не связанных с исследуемой ферментативной реакцией (адсорбция, связывание другими соединениями почвы).
На скорость ферментативной реакции влияет множество факторов. К ним относятся температура инкубации, концентрация водородных ионов, состав применяемых буферных растворов, концентрация субстрата, величина навески почвы, наличие различных активаторов и ингибиторов и т. д. При разработке почвенно – энзимологических методов определяют оптимальные значения этих констант, которые для разных групп и даже отдельных ферментов различны.
|
|
|
Навеска почвы и концентрация субстрата. Измерение активности ферментов в почве производят в определенных количествах почвенной пробы. С увеличением навески почвы скорость ферментативной реакции линейно возрастает (рис. 2)
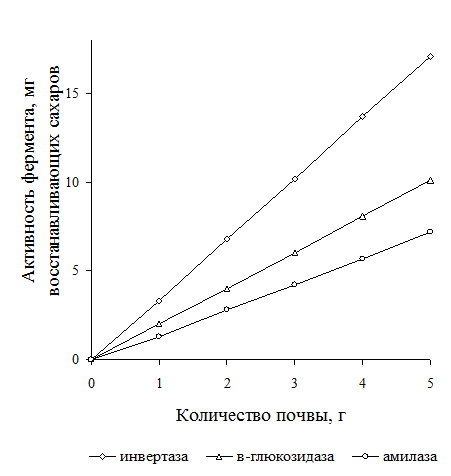
Рис.2. Влияние количества почвы на скорость ферментативной реакции
Концентрацию субстрата выбирают с таким расчетом, чтобы скорость ферментативной реакции была постоянной в течение всего периода экспозиции и количество молекул субстрата хватило для насыщения всех молекул ферментов, содержащихся в данной навеске почвы, до конца реакции. Для этого требуют некоторый избыток субстрата. Однако большой избыток субстрата снижает скорость реакции.
Оптимальная концентрация субстрата устанавливается опытным путем для определенных величин навески почвы. Иногда произвольно берут разные навески почвы и концентрации субстратов, что является недопустимым. Для получения сопоставимых данных условия должны быть стандартизированы. В первую очередь необходимо установить минимальную величину навески почвы, в которой с достаточной точностью можно обнаружить активность изучаемого фермента, и соответственно этой навеске определить оптимальную величину концентрации субстрата.
Существенным требованием к субстратам является их хорошая растворимость. Нерастворимые или слаборастворимые субстраты трудно вступают во взаимодействие с ферментами.
Реакция среды и буферные растворы. Скорость ферментативных реакций зависит от значений рН среды. Максимальная активность ферментов проявляется лишь в узком интервале значений рН, которые называют оптимум рН действия данного фермента. Как уменьшение, так и увеличение рН приводит к снижению активности ферментов (рис. 3). Поддержание оптимального и постоянного значений рН в реакционной среде на протяжении опыта при определении ферментативной активности является одним из важных методологических условий. Опытным путем устанавливается значение оптимума рН ферментов. При этом следует учесть, что почвы с различными значениями рН неодинаково влияют на сдвиг рН буферного раствора. Это зависит от буферности самой почвы, существенные сдвиги могут быть в малобуферных кислых и щелочных почвах. При определении оптимумов рН ферментов почвы после прибавления реакционной смеси к почве значение рН суспензии доводится до соответствующей величины значения буферного раствора потенциометрическим титрованием.
|
|
|
При определении ферментативной активности для обеспечения заданной рН используют буферные растворы с величиной рН, соответствующей оптимуму действия данного фермента. Предлагается также определять ферментативную активность почвы при рН почвы, так как почва - сама буферная система. Однако это зависит от цели определения активности фермента. При решении прикладных задач по ферментативной диагностике почв предпочтительно определять активность почвы при почвенном значении рН, а при исследовании чисто фундаментальных почвенно – энзимологических вопросов рН среды должен быть оптимальным для данного фермента.

Рис.3. Влияние рН среды на активность ферментов
Важное значение имеет катионно – анионный состав буферного раствора: различные катионы и анионы оказывают неодинаковое влияние на отдельные ферменты и на почвы. Так, фосфат-ионы будут ингибировать фосфатазу, если используется фосфатный буфер при определении фосфатазной активности почвы; ионы аммония могут ингибировать уреазу, если использовать аммиачный буферный раствор. Лимонно-кислые ионы буферных растворов будут связываться с ионами железа, если их много в почве. Другим важным требованием к буферным растворам является, чтобы они не растворяли и экстрагировали из почвы окрашенное органическое вещество, что будет мешать при последующем спектрофотометрическом и титрометрическом анализе продуктов ферментативной реакции. Поэтому экспериментально подбирают необходимый состав буферного раствора для каждого вида фермента и с учетом свойств почвы.
Температура инкубации. Скорость ферментативных реакций зависит от температуры. По мере повышения температуры до определенного значения скорость реакции возрастает, при высоких температурах ферменты денатурируют и теряют свою активность. Низкие температуры снижают ферментативную активность. Максимальную активность ферментов в почве обнаруживают в пределах температур от 45 до 600С (рис.4). Однако активность почвенных ферментов не определяют при оптимальных значениях температуры, так как они сильно отличаются от естественной температуры почвы за вегетативный период. Кроме того, в результате относительной деятельности сроков инкубации (от нескольких часов до нескольких суток) при таких температурных условиях может происходить некоторая термическая инактивация ферментов и разложение некоторых субстратов. Определение активности почвенных ферментов обычно производят при температуре 30 – 500С. Однако, согласно рекомендациям Международного союза по номенклатуре и классификации ферментов, необходимо придерживаться стандартной температуры 30 0С.
|
|
|

Рис.4. Влияние температуры на активность нуклеазы в почве (выщелоченный чернозем)
Продолжительность инкубации. Ферментативную активность почвы необходимо определять при начальной скорости реакции и сохранять ее постоянной в течение всего времени экспозиции (рис.5). Скорость ферментативной реакции во времени может падать в результате следующих причин:
1. уменьшения концентрации субстрата ниже насыщающей концентрации, поскольку он расходуется в процессе реакции, а также может адсорбироваться почвой;
2. частичного разрушения самих ферментов во время реакции;
3. влияния образующихся продуктов реакции, особенно на ферменты при длительных сроках.
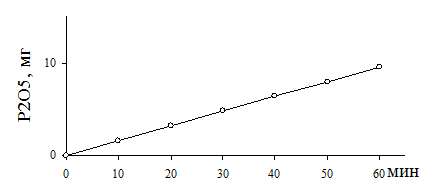
Рис.5. Изменение скорости фосфатазной реакции в почве (дерново-подзолистая почва)
При этом возможны два типа влияния: специфическое торможение активности ферментов продуктами реакции и обратимость ферментативных реакций, так как по закону действующих масс скорость обратимых реакций пропорциональна произведению концентраций реагирующих веществ.
В связи с относительной низкой активностью фермента в почве время компостирования почв с субстратом продолжительное – от нескольких часов до нескольких суток. Необходимо время инкубации сократить до минимума, чтобы исключить отрицательный эффект вышеуказанных факторов и возможность роста колоний некоторых видов микроорганизмов.
Перемешивание реакционной смеси в процессе инкубации. Ферменты в почве находятся преимущественно в адсорбированном или ином связанном состоянии почвенными коллоидами. Постоянный приток субстрата к ферментам и удаление продуктов реакции из зоны действия ферментов достигаются периодическим взбалтыванием реакционной смеси в процессе инкубации. Имеет значение частота встряхивания, которую устанавливают опытным путем при определении активности каждого фермента. Необходимо поддерживать одинаковую периодичность и энергичность встряхивания в процессе инкубации реакционной смеси.
|
|
|
Количественная экстракция продуктов реакции. Одним из важных требований к методам почвенной энзимологии является полная экстракция из почвы продуктов ферментативной реакции, по количеству которых измеряют активность фермента. В качестве экстрагентов используют соответствующие буферные растворы, различные растворители. Измеряют количество экстрагированного компонента продуктов ферментативной реакции, который не адсорбируется или минимально адсорбируется почвой. Например, при определении фосфатазной активности лучше измерять количество органической части продуктов гидролиза фенилфосфата или фенолфталеинфосфата, используемых в качестве субстрата – фенола и фенолфталеина, так как ортофосфат активно связывается почвой и по ортофосфату можно получить заниженные показатели ативности.
Контрольные пробы. В почве всегда присутствуют вещества, аналогичные продуктам распада большинства органических веществ, применяемых в качестве субстратов при почвенно-энзимологических исследованиях (глюкоза, аминокислоты, фосфор, аммоний и др.). Поэтому для корректировки результатов определения активности ферментов ставят следующие контрольные опыты.
1. Контроль на неферментативное превращение субстрата (контроль без фермента - К.б.ф.). Строго обязателен, особенно при определении активности окислительно-восстановительных ферментов, потому что в почве всегда присутствуют переменно-валентные катионы (Сu, Мn, Мо и др.), способные переносить электроны и осуществлять окислительно-восстановительные превращения. Обычно неферментативный гидролитический распад субстратов в почве незначителен или отсутствует. Для инактивации ферментов параллельные навески почв в реакционных сосудах стерилизуют сухим жаром при 180°С в течение 2-3 ч или автоклавируют при 2 атм. в течение 1 ч несколько раз. При этих условиях ферменты, иммобилизованные в почве, полностью инактивируются. Однако такие контроли нецелесообразны в тех случаях, когда продукты ферментативных реакций определяют фотометрическим методом или титрованием. Нагревание почвы при высокой температуре сильно изменяет её органическое вещество, оно становится растворимым и окрашивает фильтраты. Вместо жёсткой термической инактивации ферментов часто используют специфические химические ингибиторы: соли тяжёлых металлов, цианиды и др. В стерилизованную сухим жаром или обработанную ингибитором почву вносят антисептик, буферный раствор, субстрат и дальше проводят те же самые операции, что и с опытными пробами. В случае применения ингибитора фермента после инкубации в опытные сосуды добавляют такое же количество ингибитора. Могут быть использованы и другие эффективные способы инактивации ферментов при минимальном воздействии на почвенные свойства.
2. Контроль на почвенные вещества, учитываемые вместе с продуктами ферментативной реакции (контроль без субстрата -К.б.с). Нестерильную почву обрабатывают толуолом, вносят буферный раствор и соответствующий объём воды вместо субстрата. Дальнейшие операции аналогичны опытным процедурам.
3. Контроль на чистоту реактивов и субстрата и на спонтанный распад субстрата (контроль без почвы К.б.п) В реакционные сосуды наливают указанные в соответствующей методике количества субстрата, буфера и антисептика и эту контрольную смесь обрабатывают как опытную. Достаточно поставить один контроль для данной серии реактивов и субстрата.
При определении активности гидролитических ферментов можно ограничиваться постановкой контроля без субстрата и контроля без почвы, так как известно, что неферментативный гидролиз органических соединений в почве незначителен и за короткий срок инкубации при определении ферментативной активности почвы не может вносить существенной коррективы на результаты опыта. Кроме того, проведение этого контроля довольно хлопотно. Однако предварительно следует убедиться в том, что неферментативный гидролиз субстрата в почве не происходит, особенно в случае содержания в почве значительных количеств различных техногенных химических ингредиентов (загрязнителей), для чего ставят несколько контролей без фермента. При определении активности окислительно-восстановительных ферментов достаточен контроль без фермента, так как он включает в себя контроль без субстрата и контроль без почвы. При расчете ферментативной активности почвы (ФАП) сумму показателей контрольных проб вычитают из показателя опытных вариантов (ПР - продукт реакции), разница соответствует количеству продукта, образовавшегося в результате ферментативного превращения субстрата ФАП = ∑ ПР - ∑ К.б.ф., К.б.с, К.б.п. При пересчёте на единицу веса почвы (на 1 г, 100 г и т.д.) продукт ферментативной реакции характеризует ферментативную активность почвы.
Единицы измерения активности ферментов в почве. Активность фермента выражают в единицах ферментативного действия, что представляет собой изменения, производимые ферментом в субстрате в определённый отрезок времени при строго определённых условиях: концентрации субстрата, рН, температуре и т.д. Как методы определения активности ферментов, так и выражение результатов измерений активности весьма разнообразны. Для отдельных ферментов предложены крайне различные и произвольные единицы. Например, ферментативную активность выражают в физических изменениях субстрата (изменение вязкости, поляризации, оптической плотности), количествах продуктов реакции, количествах превращенной или остаточной части субстрата, ферментных или энергетических единицах и т.д. Отсутствие стандартных единиц измерения активности ферментов не даёт возможности сопоставить результаты даже при применении единых методов.
Наряду с разработкой стандартных условий определения активности ферментов в почве необходимо стандартизировать и способы выражения величин скорости ферментативных реакций. По-видимому, в настоящее время целесообразно сохранить наиболее широко используемую единицу измерения - количество продуктов ферментативного превращения субстрата (мкг, мг, мл, см3, мкМ и др.) на единицу веса почвы за единицу времени при 30 °С. В то же время, в соответствии с рекомендацией Международного биохимического союза по ферментам (Номенклатура ферментов, 1979) за единицу измерения принята стандартная ферментная единица (ФЕ). 1 ФЕ соответствует такому количеству фермента, которое при заданных условиях катализирует превращение 1 мкМ субстрата в 1 мин. В условиях почвенных ферментов это количество может быть рассчитано на единицу веса почвы (например, на 1 г почвы). Однако в почвенно-энзимологических исследованиях в связи с большой гетерогенностью по составу и состоянию ферментов в почве и незначительной их активности в отличие от чистых ферментных препаратов трудно производить перерасчёты на ферментные единицы. В почве определяется не активность конкретной ферментативной молекулы, а ферментативную активность почвы, т.е. проявление некоторой каталитической функции содержащихся в различном состоянии в почвенной массе ферментов (свободных, внеклеточных, внутриклеточных, иммобилизованных, связанных с клеточными фрагментами). В ферментных единицах может быть выражена активность ферментсодержащих препаратов, получаемых экстракцией из почвы. Это фундаментальное направление в почвенной энзимологии в настоящее время получает своё развитие.[25]
|
|
|


