 |
Зависимость теплового эффекта реакции от температуры.
|
|
|
|
ФИЗИЧЕСКАЯ ХИМИЯ
ВВЕДЕНИЕ
Задачей физической химии является объяснение химических явлений на основе более общих законов физики. Физическая химия рассматривает две основные группы вопросов:
1. Изучение строения и свойств вещества и составляющих его частиц;
2. Изучение процессов взаимодействия веществ.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика – наука о взаимопревращениях различных форм энергии и о законах этих превращений. Термодинамика базируется только на экспериментально обнаруженных объективных закономерностях, выраженных в двух основных началах термодинамики.
Термодинамика изучает:
1. Переходы энергии из одной формы в другую, от одной части системы к другой;
2. Энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов;
3. Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях.
Необходимо также отметить, что классическая термодинамика имеет следующие ограничения:
1. Термодинамика не рассматривает внутреннее строение тел и механизм протекающих в них процессов;
2. Классическая термодинамика изучает только макроскопические системы;
3. В термодинамике отсутствует понятие "время".
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
|
|
|
Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела.
Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы – параметры состояния. Установлено, что для однозначной характеристики данной системы необходимо использовать некоторое число параметров, называемых независимыми; все остальные параметры рассматриваются как функции независимых параметров. В качестве независимых параметров состояния обычно выбирают параметры, поддающиеся непосредственному измерению, например температуру, давление, концентрацию и т.д. Всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) есть термодинамический процесс.
Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Равновесный процесс – процесс, при котором система проходит через непрерывный ряд равновесных состояний.
Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
|
|
|
Внутренняя энергия системы – сумма кинетической и потенциальной энергии всех частиц, составляющих систему.
Формы перехода энергии от одной системы к другой могут быть разбиты на две группы. В первую группу входит только одна форма перехода движения путем хаотических столкновений молекул двух соприкасающихся тел, т.е. путём теплопроводности (и одновременно путём излучения). Мерой передаваемого таким способом движения является теплота. Во вторую группу включаются различные формы перехода движения, общей чертой которых является перемещение масс, охватывающих очень большие числа молекул (т.е. макроскопических масс), под действием каких-либо сил. Таковы поднятие тел в поле тяготения, переход некоторого количества электричества от большего электростатического потенциала к меньшему, расширение газа, находящегося под давлением и др. Общей мерой передаваемого такими способами движения является работа – форма передачи энергии путём упорядоченного движения частиц.
Теплота и работа характеризуют качественно и количественно две различные формы передачи движения от данной части материального мира к другой. Теплота и работа не могут содержаться в теле. Теплота и работа возникают только тогда, когда возникает процесс, и характеризуют только процесс. В статических условиях теплота и работа не существуют.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Первое начало термодинамики представляет собой закон сохранения энергии, один из всеобщих законов природы.
Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
Приведем еще некоторые формулировки первого начала термодинамики:
Полная энергия изолированной системы постоянна;
Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU:
Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.
 (I.1)
(I.1)
 (I.2)
(I.2)
Уравнение (I.1) является математической записью 1-го начала термодинамики для конечного, а уравнение (I.2) – для бесконечно малого изменения состояния системы.
|
|
|
Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ΔU не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях:
 (I.3)
(I.3)
Рассмотрим приложение первого начала термодинамики для определения работы, совершаемой системой при различных термодинамических процессах. Рассмотрим простейший случай – работу расширения идеального газа.
Изохорный процесс (V = const; ΔV = 0).
Поскольку работа расширения равна произведению давления и изменения объема, для изохорного процесса получаем:
 (I.1)
(I.1)
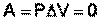 (I.4)
(I.4)
 (I.5)
(I.5)
Изотермический процесс (Т = const).
Из уравнения состояния одного моля идеального газа получаем:
 (I.6)
(I.6)
Отсюда:
 (I.7)
(I.7)
Проинтегрировав выражение (I.6) от V1 до V2, получим
 (I.8)
(I.8)
Изобарный процесс (Р = const).
 (I.9)
(I.9)
Подставляя полученные выражения для работы различных процессов в уравнение (I.1), для тепловых эффектов этих процессов получим:
 (I.10)
(I.10)
 (I.11)
(I.11)
 (I.12)
(I.12)
В уравнении (I.12) сгруппируем переменные с одинаковыми индексами. Получаем:
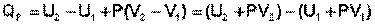 (I.13)
(I.13)
Введем новую функцию состояния системы – энтальпию H, тождественно равную сумме внутренней энергии и произведения давления на объем:

Тогда выражение (I.13) преобразуется к следующему виду:
 (I.14)
(I.14)
Т.о., тепловой эффект изобарного процесса равен изменению энтальпии системы.
Адиабатический процесс (Q = 0).
При адиабатическом процессе работа расширения совершается за счёт уменьшения внутренней энергии газа:
 (I.15)
(I.15)
Сv – молярная теплоемкость идеального газа при постоянном объеме.
В случае если Cv не зависит от температуры (что справедливо для многих реальных газов), работа, произведённая газом при его адиабатическом расширении, прямо пропорциональна разности температур:
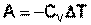 (I.16)
(I.16)
ТЕРМОХИМИЯ
Закон Гесса
Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения.
|
|
|
Тепловой эффект (теплота) химической реакции – количество теплоты, выделившейся либо поглотившейся в ходе реакции. Дадим определения некоторым понятиям термохимии.
Теплота образования вещества – тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования простых веществ принимаются равными нулю.
Теплота сгорания вещества – тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших устойчивых оксидов.
Теплота растворения – тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Теплота растворения складывается из двух составляющих: теплоты разрушения кристаллической решетки (для твердого вещества) и теплоты сольватации:

Поскольку ΔНкр.реш всегда положительно (на разрушение кристаллической решетки необходимо затратить энергию), а ΔНсольв всегда отрицательно, знак ΔНраств определяется соотношением абсолютных величин ΔНкр.реш и ΔНсольв:

Основным законом термохимии является закон Гесса, являющийся частным случаем первого начала термодинамики:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Рассмотрим некоторый обобщенный химический процесс превращения исходных веществ А1, А2, А3... в продукты реакции В1, В2, В3..., который может быть осуществлен различными путями в одну или несколько стадий:

Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
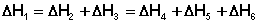 (I.17)
(I.17)
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое.
С + О2 ––> СО + 1/2 О2 ΔН1
С + О2 ––> СО2 ΔН2
СО + 1/2 О2 ––> СО2 ΔН3
 (I.18)
(I.18)
3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
С(алмаз) + О2 ––> СО2 ΔН1
|
|
|
С(графит) + О2 ––> СО2 ΔН2
С(алмаз) ––> С(графит) ΔН3
 (I.19)
(I.19)
4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
 (I.20)
(I.20)
5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
 (I.21)
(I.21)
В качестве примера рассмотрим расчет теплового эффекта реакции окисления одного моля глюкозы (теплота образования кислорода по определению равна нулю):
С6Н12О6 + 6 О2 ––> 6 СО2 + 6 Н2О

Величины тепловых эффектов химических реакций зависят от условий, в которых проводятся реакции. Поэтому табличные значения теплот различных процессов принято относить к стандартному состоянию – температуре 298 К и давлению 101325 Па (760 мм. рт. ст.; 1 атм.); величины тепловых эффектов при данных условиях называют стандартными тепловыми эффектами и обозначают ΔН°298 и ΔU°298 соответственно.
Зависимость теплового эффекта реакции от температуры.
Закон Кирхгофа
В общем случае тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на ΔН и ΔU реакции обычно пренебрегают. Влияние температуры на величины тепловых эффектов описывает закон Кирхгофа:
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции.
 (I.26)
(I.26)
 (I.27)
(I.27)
Для химического процесса изменение теплоемкости задается изменением состава системы и рассчитывается следующим образом:
 (I.28)
(I.28)
 (I.29)
(I.29)
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ
Первое начало термодинамики позволяет рассчитать энергетический эффект процесса, однако не дает ответа на вопросы о том, будет ли процесс протекать самопроизвольно, о направлении и глубине протекания процесса.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать или обратимо, или необратимо. В случае обратимо происходящего изменения состояния системы производится максимальное количество работы. Всякий реальный процесс в какой-то степени является необратимым, и получаемая работа меньше максимально возможного теоретического количества.
Вынужденный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса. Второе начало термодинамики также дает возможность определить, какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени. Второе начало термодинамики имеет ограниченную область применения: оно применимо лишь к макроскопическим системам. Приведем некоторые формулировки второго начала термодинамики:
Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому (постулат Клаузиуса).
Невозможен процесс, единственным результатом которого является превращение теплоты в работу.
Невозможно построить машину, все действия которой сводились бы к производству работы за счет охлаждения теплового источника (вечный двигатель второго рода).
Рассмотрим работу тепловой машины, т.е. машины, производящей работу за счет теплоты, поглощаемой от какого-либо тела, называемого нагревателем. Нагреватель с температурой Т1 передает теплоту Q1 рабочему телу, например, идеальному газу, совершающему работу расширения А; чтобы вернуться в исходное состояние, рабочее тело должно передать телу, имеющему более низкую температуру Т2 (холодильнику), некоторое количество теплоты Q2, причем
 (I.34)
(I.34)
Отношение работы А, совершенной тепловой машиной, к количеству теплоты Q1, полученному от нагревателя, называется термодинамическим коэффициентом полезного действия (КПД) машины η:
 (I.35)
(I.35)
Для получения математического выражения второго начала термодинамики рассмотрим работу идеальной тепловой машины (машины, обратимо работающей без трения и потерь тепла; рабочее тело – идеальный газ). Работа машины основана на принципе обратимого циклического процесса – термодинамического цикла Карно (рис. 1.2).

Рисунок 1.2. Цикл Карно
Запишем выражения для работы на всех участках цикла:
Участок 1 – 2: Изотермическое расширение.
 (I.36)
(I.36)
Участок 2 – 3: Адиабатическое расширение.
 (I.37)
(I.37)
Участок 3 – 4: Изотермическое сжатие.
 (I.38)
(I.38)
Участок 4 – 1: Адиабатическое сжатие.
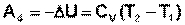 (I.39)
(I.39)
Общая работа в цикле равна сумме работ на всех участках:
 (I.40)
(I.40)
Проведя ряд несложных преобразований, получим для КПД идеальной тепловой машины, работающей по циклу Карно:
 (I.41)
(I.41)
Т.о., максимальный КПД тепловой машины не зависит от природы рабочего тела, а определяется только разностью температур нагревателя и холодильника. Очевидно, что без перепада температур превращение теплоты в работу невозможно.
Для необратимо работающей тепловой машины уравнение (I.41) преобразуется в неравенство:
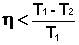 (I.42)
(I.42)
Для общего случая можем записать:
 (I.43)
(I.43)
На основе анализа работы идеальной тепловой машины Карно можно сделать следующий вывод, являющийся также одной из формулировок второго начала термодинамики:
Любая форма энергии может полностью перейти в теплоту, но теплота преобразуется в другие формы энергии лишь частично.
Одной из движущих сил химической реакции является уменьшение энтальпии системы, т. е. экзотермический тепловой эффект реакции. Большинство экзотермических реакций (DН<0) протекает самопроизвольно. Однако это условие не может быть критерием самопроизвольного течения реакций, т. к. существуют самопроизвольные процессы, для которых DН>0, например, растворение некоторых солей в воде.
Следовательно, кроме уменьшения энтальпии системы имеется другая движущая сила протекания самопроизвольного процесса. Такой силой является стремление частиц (молекул, ионов, атомов) к хаотичному движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Таким образом, критерием направленности процесса может служить степень неупорядоченности системы. Мерой этой неупорядоченности является функция S наз. энтропией. Энтропия – мера неупорядоченности. В наиболее неупорядоченном состоянии энтропия будет максимальной.
Количественная связь между энтропией S и термодинамической вероятностью W выражается формулой Больцмана:
 (I.58)
(I.58)
С точки зрения статистической термодинамики второе начало термодинамики можно сформулировать следующим образом:
В изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся увеличением энтропии.
Энтропия изолированной системы не может самопроизвольно убывать.
Таким образом, если DS>0, то процесс термодинамически возможен; если DS<0, то его самопроизвольное протекание невозможно.
В открытых системах возможны процессы сопровождающиеся уменьшением энтропии. Это не противоречит второму закону термодинамики, т. к. уменьшение энтропии в одном месте компенсируется созданием эквивалентной или еще большей неупорядоченности где-то в другом месте.
Наглядным примером служит процесс фотосинтеза. Углекислый газ, вода и другие вещества поглощаются растениями, которые синтезируют из них сложные молекулы углеводов. Этот процесс сопровождается понижением энтропии. Чтобы происходил процесс фотосинтеза растениям необходима солнечная энергия. Поэтому уменьшение энтропии компенсируется ее возрастанием на Солнце.
ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ
Ранее было показано, что внутреннюю энергию системы можно условно представить в виде суммы двух величин "свободной" и "связанной" энергии. Возможность рассчитать величину "свободной" энергии, т.е. той части внутренней энергии системы, которую можно превратить в работу, дает тепловая теорема Нернста, называемая также третьим началом термодинамики.
Основные положения тепловой теоремы заключаются в следующем:
1. При абсолютном нуле температуры свободная энергия X равна теплоте процесса.
 (I.59)
(I.59)
2. При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
 (I.60)
(I.60)
Одной из формулировок третьего начала термодинамики является также постулат Планка:
Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Изменение энтропии однозначно определяет направление и предел самопроизвольного протекания процесса лишь для наиболее простых систем – изолированных. На практике же большей частью приходится иметь дело с системами, взаимодействующими с окружающей средой. Для характеристики процессов, протекающих в закрытых системах, были введены новые термодинамические функции состояния: изобарно-изотермический потенциал (свободная энергия Гиббса) и изохорно-изотермический потенциал (свободная энергия Гельмгольца).
Поведение всякой термодинамической системы определяется одновременным действием двух факторов – энтальпийного, отражающего стремление системы к минимуму тепловой энергии, и энтропийного, отражающего противоположную тенденцию – стремление системы к максимальной неупорядоченности. Если для изолированных систем (ΔН = 0) направление и предел самопроизвольного протекания процесса однозначно определяется величиной изменения энтропии системы ΔS, а для систем, находящихся при температурах, близких к абсолютному нулю (S = 0 либо S = const) критерием направленности самопроизвольного процесса является изменение энтальпии ΔН, то для закрытых систем при температурах, не равных нулю, необходимо одновременно учитывать оба фактора. Направление и предел самопроизвольного протекания процесса в любых системах определяет более общий принцип минимума свободной энергии:
Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения.
Для закрытых систем, находящихся в изобарно-изотермических либо изохорно-изотермических условиях свободная энергия принимает вид изобарно-изотермического либо изохорно-изотермического потенциалов (т.н. свободная энергия Гиббса и Гельмгольца соответственно).
 (I.73)
(I.73)
Функция  есть изохорно-изотермический потенциал (свободная энергия Гельмгольца), определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях.
есть изохорно-изотермический потенциал (свободная энергия Гельмгольца), определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях.
Закрытую систему, находящуюся в изобарно-изотермических условиях, характеризует изобарно-изотермический потенциал G:
 (I.75)
(I.75)
Поскольку –ΔG = Amax, можно записать:
 (I.76)
(I.76)
Величину А'max называют максимальной полезной работой (максимальная работа за вычетом работы расширения). Основываясь на принципе минимума свободной энергии, можно сформулировать условия самопроизвольного протекания процесса в закрытых системах.
Изобарно-изотермические (P = const, T = const):
ΔG < 0.
Изохорно-изотермические (V = const, T = const):
ΔF < 0.
Процессы, которые сопровождаются увеличением термодинамических потенциалов, протекают лишь при совершении работы извне над системой. В химии наиболее часто используется изобарно-изотермический потенциал, поскольку большинство химических (и биологических) процессов происходят при постоянном давлении.
Величина стандартного изменения изобарно-изотермического потенциала в ходе химической любой реакции ΔG°298 есть мера химического сродства исходных веществ. Основываясь на уравнении (I.75), можно оценить вклад энтальпийного и энтропийного факторов в величину ΔG и сделать некоторые обобщающие заключения о возможности самопроизвольного протекания химических процессов, основываясь на знаке величин ΔН и ΔS.
1. Экзотермические реакции; ΔH < 0.
а) Если ΔS > 0, то ΔG всегда отрицательно; экзотермические реакции, сопровождающиеся увеличением энтропии, всегда протекают самопроизвольно.
б) Если ΔS < 0, реакция будет идти самопроизвольно при ΔН > TΔS (низкие температуры).
2. Эндотермические реакции; ΔH > 0.
а) Если ΔS > 0, процесс будет самопроизвольным при ΔН < TΔS (высокие температуры).
б) Если ΔS < 0, то ΔG всегда положительно; самопроизвольное протекание эндотермических реакций, сопровождающихся уменьшением энтропии, невозможно.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG < 0, dF < 0). Очевидно, что рано или поздно система достигнет минимума свободной энергии. Условием минимума некоторой функции Y = f(x) является равенство нулю первой производной и положительный знак второй производной: dY = 0; d2Y > 0. Таким образом, условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала:
Изобарно-изотермические (P = const, T = const):
ΔG = 0 dG = 0, d2G > 0
Изохорно-изотермические (V = const, T = const):
ΔF = 0 dF = 0, d2F > 0
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Рассмотрим частный случай термодинамического равновесного состояния – химическое равновесие. Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P или мольные доли X реагирующих веществ. Для некоторой реакции

соответствующие константы равновесия выражаются следующим образом:
 (I.78)
(I.78)  (I.79)
(I.79)
 (I.80)
(I.80)
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры.
Можно записать:
 (I.84)
(I.84)
Константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Введем понятие химический потенциал. Химический потенциал компонента связан с его парциальным давлением или концентрацией следующими соотношениями:
 (I.87)
(I.87)
 (I.88)
(I.88)
Здесь μ°i – стандартный химический потенциал компонента (Pi = 1 атм., Сi = 1 моль/л.).
В общем виде условие химического равновесия можно записать следующим образом:
 (I.94)
(I.94)
Выражение (I.94) носит название уравнения Гиббса – Дюгема. Подставив в него зависимость химического потенциала от концентрации, получаем:
 (I.97)
(I.97)
Данное выражение есть изотерма химическойреакции. Если система находится в состоянии химического равновесия, то изменение термодинамического потенциала равно нулю; получаем:
 (I.99)
(I.99)
Здесь рi – равновесные парциальные давления исходных веществ и продуктов реакции.
Уравнение (I.99) показывает связь константы равновесия со стандартным изменением свободной энергии в ходе реакции. Уравнение изотермы химической реакции связывает величины реальных концентраций (давлений) реагентов в системе, стандартного изменения термодинамического потенциала в ходе реакции и изменения термодинамического потенциала при переходе из данного состояния системы в равновесное. Знак ΔG определяет возможность самопроизвольного протекания процесса в системе. При этом ΔG° равно изменению свободной энергии системы при переходе из стандартного состояния (Pi = 1 атм.) в равновесное. Уравнение изотермы химической реакции позволяет рассчитать величину ΔG при переходе из любого состояния системы в равновесное, т.е. ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях давлениях Рi реагентов:
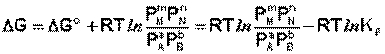 (I.101)
(I.101)
Если изменение термодинамического потенциала меньше нуля, процесс в данных условиях будет протекать самопроизвольно.
|
|
|


