 |
Биосинтез белков – трансляция
|
|
|
|
Сборка полипептидной цепи белка из составляющих ее аминокислот включает четыре стадии: активацию и отбор аминокислот; инициацию синтеза полипептидной цепи; элонгоцию (удлинение) полипептидной цепи; терминацию синтеза полипептидной цепи.
Первая стадия – активация – это превращение аминокислоты в аминоацил – тРНК.
Взаимодействие тРНК с аминокислотами – ферментативный процесс, приводящий к образованию ковалентной сложноэфирной связи между аминокислотой и тРНК.
синтетаза
Аминокислота + АТФ + т РНК–––––® Аминоацил – тРНК + АМФ+ Н4Р2О7
Известно не менее двадцати различных аминоацил – тРНК – синтетаз, каждая из которых катализирует реакцию только одной из 20 аминокислот с тРНК, соответствующей этой аминокислоте. Каждая синтетаза высокоспецифична, в ее активном центре находится участок, комплементарный какой-то части молекулы одной из тРНК. Это позволяет каждой синтетазе соединять определенную аминокислоту с соответствующей тРНК.
Вторая стадия синтеза белка – инициация – начинается с образования инициирующего комплекса.
Поступившая из ядра в цитоплазму мРНК соединяется с малой (40 S) субъединицей рибосомы и инициирующим ей аминоацилом – тРНК. Затем к этому комплексу присоединяется большая (60 S) субъединица рибосомы.
Инициирующий аминоацил – тРНК – содержит аминокислоту метионин – Меt – тРНК. В дальнейшем Меt – тРНК взаимодействует своим триплетом нуклеотидов, комплементарным кодом АУГ или ЦУЦ на мРНК. Эти два кодона на мРНК называют инициирующими. С одного из них начинается синтез любого белка.
Третья стадия – элонгация. Процесс элонгации начинается со связывания аминоацил – тРНК – с инициирующим комплексом, соответствующим первому кодону мРНК, следующему за инициирующим кодоном. Кодон мРНК должен спариваться с антикодоном, т.е. с таким триплетом в молекуле тРНК, который комплементарно ему соответствует. Эта тРНК взаимодействует затем не только с мРНК, но и с определенными участками рибосомы – центрами связывания – пептидильным (донорным) и акцепторным. В процессе связывания аминоацила – тРНК– расходуется одна молекула ГTФ. Затем начинается образование пептидной связи между инициаторным метионином из Меt-тРНК и первой в будущей полипептидной цепи аминокислотой, включенной в аминоацил-тРНК. Образовавшийся дипептидил – тРНК – связан с кодоном, соответствующим аминокислоте, и центром связывания рибосомы.
|
|
|
Затем происходит транслокация – перемещение рибосомы относительно мРНК и дипептидил-тРНК. В результате этого перемещения дипептидил-тРНК оказывается в пептидильном центре рибосомы, а тРНК метионина освобождается из комплекса. На транслокацию расходуется две молекулы ГTФ.
Дальнейшее удлинение пептидной цепи происходит путем повторения этих фаз, но теперь уже присоединяется аминоацетил-тРНК, соответствующий второму коноду мРНК, в результате чего образуется трипептид и т.д.(рис 3):
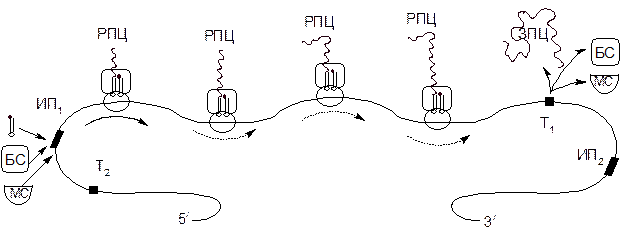
Рисунок 3 – Схема действия полирибосомы, состоящей из четырех рибосом
МС– малая субчастица рибосомы (40S); БС – большая частица рибосомы (60S); РПЦ и ЗПЦ – растущая и завершенная полипептидные цепи; ИП1 и ИП2 – кодоны – инициаторы и участок, узнаваемый рРНК; Т1 и Т2 – кодоны–терминаторы, прерывающие синтез белка.
Остаток аминокислоты инициаторного метионина, участвовавший в стадии инициации и занимающий в растущей пептидной цепи N-концевое положение, отщепляется в стадии элонгации.
Следует отметить, что метионин, встраиваемый не в начало цепи (инициаторный метионин), а внутри – переносится другой тРНК.
Четвертая стадия – терминация. Удлинение пептидной цепи продолжается до тех пор, пока на пути рибосомы не встретится один из терминальных триплетов мРНК. Это триплеты УAA, УAГ или УГA, сигнализирующие окончание синтеза полипептидной цепи. В узнавании этих терминальных конодов участвуют внерибосомные белки – факторы терминации или факторы высвобождения белка, под действием которых происходит гидролитическое расщепление связи между полипептидом и последней тРНК, и высвобождается полипептидная цепь готового белка. После освобождения полипептидной цепи фактор высвобождения, а также мРНК диссоциируют. У растений обнаружен лишь один фактор.
|
|
|
Вторичная и третичная структуры белков формируются в процессе трансляции по мере удлинения пептидной цепи. Как уже отмечалось в разделе «Белки», пространственные структуры белковой молекулы определяются первичной структурой ее полипептидной цепи. В результате формирования вторичной и третичной структур образуются активные центры белков.
В то же время в процессе трансляции и после ее завершения не всегда формируется биологически активный белок. В ряде случаев сформированные молекулы белков-ферментов неактивны, и переход их в активную форму возможен после отщепления части полипептидной цепи путем частичного гидролиза. Так, например, в созревающих семенах ферменты протеазы синтезируются в неактивной форме, они не способны гидролизовать собственные запасные белки до прохождения частичного гидролиза полипептидной цепи молекулы фермента. Только после частичного гидролиза, в результате которого отщепляются трипептид, протеаза переходит в активную форму и начинает гидролизовать запасные белки семян. Продукты гидролиза белков поступают в прорастающий зародыш семени.
Присоединение к молекуле белка простетической группы – кофермента или металла, объединение олигомерных белков в четвертичную структуру также происходят уже после завершения процесса трансляции. В некоторых белках после завершения синтеза полипептидной цепи происходит модификация аминокислотных остатков, например, присоединение дополнительных метильных групп, йодирование, окисление двух остатков цистеина с образованием дисульфидного мостика, гидроксилирование остатков пролина, присоединение сахаров к остатку аспарагина при образовании гликопротеинов, фосфорилирование гидроксильных групп серина или тирозина у некоторых ферментов, присоединение КоА в ацилпереносящем белке синтетазы жирных кислот.
|
|
|
В реальной живой клетке синтез белков протекает не на одной рибосоме, а на комплексе или кластере рибосом – полисоме. Каждая стадия трансляции (инициация, элонгация и терминация) осуществляется каждой рибосомой. Обычно кластеры содержат от 3 до 20 рибосом, но очень большие молекулы мРНК, состоящие из тысяч нуклеотидов, могут образовывать комплексы, содержащие от 50 до 100 рибосом. Скорость синтеза полипептида очень высока: синтез пептида из 100 аминокислот занимает около 2 минут.
Общая схема процесса синтеза белка может быть представлена в следующем виде:
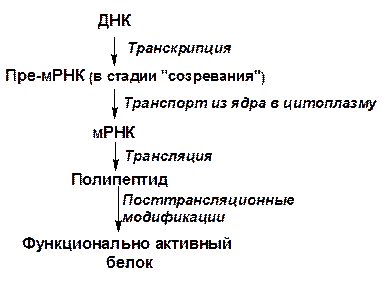
Понятие о мутациях
Выше указывалось, что состав ДНК в процессе репликации не меняется. Копирование ДНК создает молекулярную основу одного из фундаментальных свойств жизни – наследственность. Противоположное свойство – изменчивость – столь же существенно, поскольку наряду с наследственностью обеспечивает возможность естественного отбора и биологической эволюции.
Молекулярную основу изменчивости организмов составляют наследственные изменения первичной структуры ДНК – мутации, которые могут происходить из-за целого ряда причин. Например, имеющиеся азотистые основания могут быть заменены другими их аналогами или вовсе выпасть из молекулы. Совершенно очевидно, что если в результате таких ошибок образуется ДНК, не характерная для данного вида, то она после самоудвоения дает начало новым нехарактерным молекулам, что ведет к синтезу измененного «неправильного белка» или к прекращению синтеза белка, т.е. к мутациям.
Но случайные ошибки и соответственно спонтанные мутации встречаются исключительно редко. Количество мутаций можно увеличить искусственно, если подвергнуть организмы (или их клетки) действию ионизирующей радиации, действию УФ-лучей или же обработать определенными химическими веществами, которые называют мутагенами.
|
|
|
Мутагены – это чужеродные химические соединения увеличивающие число мутаций. Некоторые мутагены химически изменяют структуру пуринов или пиримидинов, приводя к изменению характера спаривания оснований. Сравнительно простой пример дает мутагенное превращение цитозина в урацил (окислительное дезаминирование), которое можно вызвать, действуя на клетку азотной кислотой (рис 4):
1) превращение цитозина в урацил;
2) расхождение цепей материнской ДНК и синтез на них комплементарных цепей. Одна из дочерних клеток получает ДНК с парой А–У в отличие от другой дочерней клетки, которая, как и материнская, содержит в этом месте ДНК пару Г–Ц.
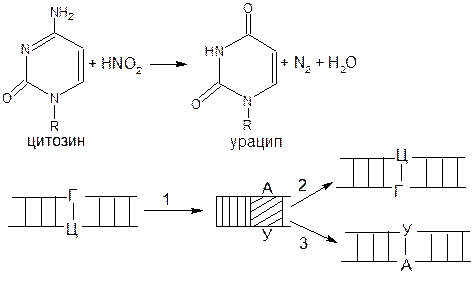
Рисунок 4 – Мутация, вызванная дезаминированием цитозина
Замена нуклеотида может привести к изменению смысла кодона и, следовательно, к синтезу измененного белка. Так возникла, например, мутация, проявляющая как серповидноклеточная анемия: кодон, ответственный за включение глутаминовой кислоты в положение 6 β–цепи гемоглобина, превратился в кодон валина.
Мутации могут быть нейтральными, полезными или вредными. К нейтральным относятся такие мутации, когда замена аминокислотного остатка в белке не сказывается на его функции. Это происходит при замене одной аминокислоты на другую, сходную по свойствам, – по заряду, по гидрофобности, размерам боковой группы.
Если в результате мутации свойства белка изменяются таким образом, что особь получает преимущество для выживания, то мутация биологически полезна. Чаще всего мутации бывают вредными. Эксперимент исследования и практический опыт показали, что случайное вмешательство в сложно организованную отлаженную эволюцией систему редко оказывалось полезной для нее, а чаще всего велика вероятность вредных последствий.
Переваривание белков
Белки, поступившие в организм с пищей, в желудочно-кишечном тракте расщепляются до аминокислот при действии группы протеолитических ферментов – пептидгидролаз (по современной номенклатуре); широко известно их тривиальное название – протеазы, или протеиназы. Эти ферменты катализируют гидролитическое расщепление пептидной связи в белках.
Протеолитические ферменты животных и человека изучены достаточно хорошо, в меньшей степени исследованы растительные протеазы.
Для протеолитических ферментов характерен ряд общих свойств и особенностей.
Ферменты, расщепляющие белки, обладают относительной субстратной специфичностью, которая определяется:
– длиной полипептидной цепи;
|
|
|
– структурой радикалов аминокислотных остатков, образующих гидролизуемую пептидную связь;
– положением связи в полипептиде.
Внутренние пептидные связи расщепляются эндопептидазами, концевые – экзопептидазы:
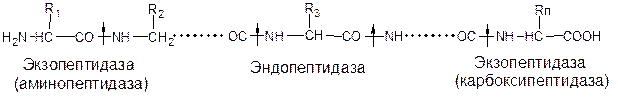
Все протеолитические ферменты синтезируются в виде неактивных предшественников, называемых зимогенами или проферментами, и таким образом клетки защищены от контакта с активной формой фермента и автолиза. Превращение зимогена в активный фермент происходит путем необратимой ковалентной модификации зимогена за счет локального протеолиза, т.е. разрыва одной или нескольких пептидных связей и отщепления ограниченного числа аминокислотных остатков. Это вызывает конформационные изменения в полипептиде, достаточные для формирования пространственной структуры активного центра фермента.
Расщепление пищевых белков начинается с действия протеолитического фермента – пепсина. В клетках слизистой оболочки желудка пепсин содержится в неактивной форме, называемой зимогеном – пепсиногеном. Специализированные клетки эпителия желудка секретируют соляную кислоту, создавая в желудке кислую среду (рН~1,5-2,0). Этот фактор имеет важное значение в переваривании белков: денатурирует белки пищи, оказывает бактерицидное действие, убивая попадающие с пищей микроорганизмы, является инициирующим фактором активации пепсиногена и превращения его в активную форму. В кислой среде желудочного сока некоторые группы пепсиногена протонируются, изменяется его конформация, в результате чего пепсиноген приобретает протеолитическую активность. При этом субстратом активированного пепсиногена служит тоже пепсиноген: одна молекула пепсиногена отщепляет от другой молекулы пепсиногена N – концевую часть включающую 42 аминокислотных остатка. В результате образуется фермент пепсин. Образовавшийся пепсин также может катализировать превращение пепсиногена в пепсин. В этом случае активацию можно представить как циклический процесс с механизмом обратной связи: продукт реакции пепсин ускоряет свое собственное образование.
В результате действия пепсина белки в желудке распадаются на полипептиды; свободные аминокислоты при этом практически не образуются. Пепсин наиболее активно гидролизует пептидные связи, NH2- группа которых принадлежит ароматическим аминокислотам – тирозину, фенилаланину, триптофану.
Дальнейшее превращение высокомолекулярных пептидов и белков, не расщепленных пепсином, происходит тремя эндопептидазами, вырабатываемыми поджелудочной железой в виде предшественников – трипсиногена, химотрипсиногена и проэластазы.
Активация трипсиногена происходит при участии фермента энтеропептидазы, выделяемого клетками кишечника. Энтеропептидаза отщепляет N-концевой гексапептид трипсиногена, в результате чего происходит изменение конформации оставшейся части молекулы и формируется активный центр – получается фермент трипсин. Основное количество трипсиногена активируется трипсином путем аутокатализа.
Трипсин обладает сравнительно узкой субстратной специфичностью, разрывая пептидные связи, в образовании которых участвуют карбоксильные группы лизина и аргинина, т.е. основных аминокислот.
В поджелудочной железе синтезируется ряд химотрипсинов (a-, b-, p– химотрипсины) из двух предшественников – химотрипсиногена А и химотрипсиногена В. Активируются зимогены в кишечнике под действием активного трипсина и химотрипсина.
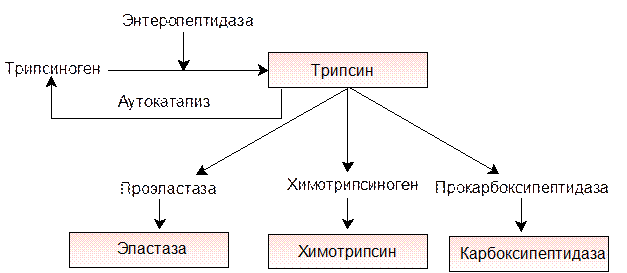
Рисунок 5 – Активация протеиназ в кишечнике
Химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только пептидов, но и эфиров, амидов и других ацилпроизводных, хотя наибольшую активность он проявляет по отношению к пептидным связям, в образовании которых принимают участие карбоксильные группы ароматических аминокислот – фенилаланина, тирозина и триптофана.
В поджелудочной железе синтезируется еще одна эндопептидаза – эластаза. Название фермент получил от субстрата эластина, который он гидролизует. Эластин богат глицином и аланином, содержится в соединительной ткани. Эластаза обладает широким спектром действия, гидролизуя субстраты, не расщепляемые трипсином и химотрипсином.
В превращении нативных белков и продуктов их гидролиза в тонком кишечнике активное участие принимают экзопептидазы. Карбоксипептидазы синтезируются в неактивном состоянии в поджелудочной железе и активизируются трипсином в кишечнике. Карбоксипептидаза А гидролизует пептидные связи С -концевых аминокислот, образованные преимущественно ароматическими аминокислотами (фенилаланин, тирозин, триптофан), а карбоксипептидаза В -связи, в образовании которых участвуют С -концевые лизин и аргинин.
Аминопептидазы вырабатываются в клетках слизистой оболочки кишечника сразу в активной форме. Из кишечного сока выделены два типа аминопептидаз, различающиеся по субстратной специфичности – аланинаминопептидаза и лейцинаминопептидаза, первая из которых гидролизует пептидную связь, образованную N -концевым аланином, а вторая способна гидролизовать практически любую пептидную связь, образованную N -концевой аминокислотой.
Процесс переваривания пептидов, их расщепление до свободных аминокислот в тонком кишечнике завершают три- и дипептидазы.
|
|
|


