 |
Начнем мы с рссмотрения атома.
|
|
|
|
КУРС «ФИЗИЧЕСКИЕ ОСНОВЫ МИКРОЭЛЕКТРОНИКИ»
ЗАНЯТИЕ №1
ВВЕДЕНИЕ
Раздел 1. Развитие микроэлектроники
Раздел 2. Цели изучения дисциплины
Раздел 3. Программа изучения
1. Цели изучения дисциплины, программа изучения
Виды и объем занятий по дисциплине
| |||||||||||||||||||||||||||||||
| Цель изучения дисциплины: -изучение физических законов и явлений, на которых основано функционирование элементов современной микроэлектроники. Задачи дисциплины: заключаются в формировании научных представлений, умений и навыков по следующим направлениям: 1) элементы зонной теории твердых тел; 2) статистика электронов и дырок в полупроводниках; 3) электропроводность металлов и полупроводников; 4) электрофизические свойства p-n-переходов и структур металл-диэлектрик-полупроводник; 5) основные принципы работы полевых транзисторов; 6) методы исследования физических процессов и определения параметров полупроводниковых материалов и структур. |
2. ФОМЭ является основой для изучения последующих дисциплин:
- Электроника и микроэлектроника
- Интегральные устройства радиоэлектроники
- Схемотехника
ВСПОМНИМ разделы из предыдущего курса по материаловедению:
Классификация материалов (конструкционные, функциональные)
Электротехнические материалы:
проводниковые, полупроводниковые и диэлектрические материалы.
Условно к проводникам относят материалы с удельным электрическим сопротивлением r < 10-5 Ом×м, а к диэлектрикам – материалы, у которых r > 108 Ом×м. Удельное сопротивление полупроводников в зависимости от строения и состава материалов, а также от условий их эксплуатации может изменяться в пределах 10-5 - 108 Ом×м.
|
|
|
Мы изучили в дисцилпне «Материаловедение и материалы РЭС» следующие разделы:
Строение твердых тел
Типы межатомной связи
1.3.1 Ионная связь; 1.3.2. Ковалентная связь
1.3.3. Металлическая связь; 1.3.4. Водородная связь
Кристаллическая решетка
Мы изучили: ПРОВОДНИКОВЫЕ МАТЕРИАЛЫ, ДИЭЛЕКТРИЧЕСКИЕ МАТЕРИАЛЫ, МАГНИТНЫЕ МАТЕРИАЛЫ
Мы подошли с вами к разделу «ПОЛУПРОВОДНИКОВЫЕ МАТЕРИАЛЫ».
Теперь уже в рамках данного курса мы рассмотрим данный раздел с точки зрения микроэлектроники, т.е. все характеристики, свойства и прочее по полупроводниковым материалам, что позволит перейти к следующим курсам: полупроводниковым приборам, устройствам, основам схемотехники.
Начнем мы изучение с раздела строение твердых тел
Строение твердых тел (Пасынков МЭТ) стр.9
Основными элементарными частицами, из которых построены все известные вещества, являются атомы, ионы, молекулы и их сочетания.
Начнем мы с рссмотрения атома.
Атом состоит из атомного ядра и электронов.
Атомные ядра в свою очередь СОСТОЯТ из положительно заряженных протонов и незаряженных нейтронов, которые связаны между собой при помощи сильного взаимодействия.
Атомы классифицируются по количеству протонов и нейтронов в ядре:
- число протонов (Z) соответствует порядковому номеру атома в периодической системе Менделеева и определяет принадлежность к некоторому химическому элементу;
- число нейтронов (N) определяет принадлежность к определнному изотопу этого элемента.
Число протонов (Z) определяет суммарный электрический положительный заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
|
|
|
Если число протонов совпадает с числом электронов, то Атом в целом оказывается электрически нейтральным.
Если число протонов не совпадает с числом электронов, то Атом оказывается положительно или отрицательно заряженным и назывется ионом.
Если ядро можно представить в виде шарика, то его радиус можно довольно точно представить по формуле
Формула: r=1,3*10-15 А1/3, (1.1)
Где: А- массовое число элемента (относительная атомная масса)
В простейшей планетарной модели атома (предложенной Резерфордом) электроны вращаются по круговым орбитам односительно ядра (См. рисунок)
При движении электронов по орбите возникает центробежная сила
F=  , (1.2)
, (1.2)
Сила, действующая между электроном и ядром, подчиняется закону Кулона:
F=  , (
, ( ) (1.3)
) (1.3)
Условию сохранения радиуса орбиты отвечает равновесие центробежной силы, отталкивающей электрон от ядра и Кулоновской силой притяжения
 =
=  . (1.4)
. (1.4)
Где:
м - масса электрона;
V - скорость движения электрона по орбите:
Z – атомный номер, е – заряд электрона, Zе – заряд ядра;
- электрическая постоянная =8,5*10-12 Ф/м
Полная энергия электрона Э в атоме складывается из кинетической энергии движения по орбите Эк и потенциальной энергии Эп обусловбенной полем протонов
Формула:
Э=  -
-  (1.5)
(1.5)
Для устранения протворечий планетарной модели Резрфорда Бор пастулировал квантовые условия для движения електрона в атоме, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергитических состояниях, не излучает энергию.
В результате Бор установил, что стабильны только те орбиты, для которых момент количества движения оказываются кратными постоянной Планка:
Формула: me×V×r=  , (1.6)
, (1.6)
Где: n - главное квантовое число n – 1,2,3…
h - постоянная Планка, h =6,62*10-34 Дж*с
Исходя из этого, можно определить те энергетические уровни и
радиусы стационарных орбит, которые может иметь электрон в атоме
r=  (1.7)
(1.7)
где n=1, 2, 3, … cоответствующие последовательным квантовым числам радиусы орбит.
r1=0,53×10-10 м, r2=2,12×10-10 м, r3=4,78×10-10 м, r4=8,5×10-10 м, r5=13,3×10-10 м.
Еn= - 
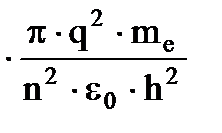 = -
= -  ×
×  (1.8) к
(1.8) к
Таким образом, химические свойства атомов определяются конфигурацией электронной и строением внешней не полностью заполненной электронами оболочки.
|
|
|
|
|
|


