 |
Обследование пастбищ и водоемов при биогельминтозах
|
|
|
|
Заражение животных на пастбищах, в местах прогона и из водоемов биогельминтами зависит исключительно от наличия там промежуточных хозяев, а также степени их зараженности гельминтами.
В европейской части нашей страны промежуточным хозяином для фасциол служит пресноводный моллюск Galba truncatula (L. truncatula) — малый, или усеченный, прудовик. При влажности ниже 45 % малые прудовики погибают (В. В. Горохов, 1973). Биотопы малого прудовика отличаются большим разнообразием — это небольшие лужи, мочажины, неглубокие болота, пруды и т. д. Плотность его на 1 м2 колеблется от единичных экземпляров до нескольких сотен. Биотопы малого прудовика могут быть постоянными или временными. Малый прудовик предпочитает поселяться на богатых гумусом почвах, хорошо освещенных солнцем.Как правило, его нет в водоемах на глубине более 20 см или он там встречается редко.
Малый прудовик откладывает яйца на остатках растительности, на кусках дерева, на камнях или просто на влажной почве, даже в самой воде. В каждой кладке одного моллюкса содержится от 4 до 30 яиц. Подсчитано, что за 16 дней один такой моллюск может отложить до 400 яиц (S. В. Кеndall, 1953). Молодые особи выходят из яиц через 10-32 дня после их откладки (в зависимости от температуры и влажности), а половозрелыми моллюски малого прудовика становятся через 21-63 дня после вылупления из яиц. При благоприятных условиях уже во второй генерации потомство одного моллюска малого прудовика может достичь 160 тыс. экземпляров (Е. Е. Шумакович, 1973). В условиях Беларуси и Нечерноземной зоны России яйцекладка малого прудовика может проходить с мая по сентябрь, в течение этого времени каждый моллюск откладывает яйца 2-3 раза. Считают, что срок жизни малого прудовика от года до 4 лет.
|
|
|
На наличие моллюсков малого прудовика осматривают прибрежную часть водоемов, берега, растительность, дно у берега водоемов на глубину до 20 см. Определяют плотность популяции из расчета на 1 м2. Обследование пастбищ проводят в теплое время года при температуре не ниже 20 °С. Особое внимание необходимо уделять низменным местам, заросшим травой. Отобранных в биотопах моллюсков определяют до вида.
Исследование некоторых промежуточных и резервуарных хозяев на наличие гельминтов
Моллюски могут принимать участие в развитии трематод, некоторых цестод и нематод. Для исследования моллюска освобождают от раковины, помещают в чашки Петри, расчленяют на отдельные части и микроскопируют с помощью компрессория. Малых прудовиков, планорбид и других мелких моллюсков исследуют, не снимая раковин. При микроскопии в поле зрения можно найти тре-матод в различных стадиях развития — спороцисты, редии, церкарии, метацеркариев.
Для исследования малого прудовика — промежуточного хозяина фасциолы обыкновенной из каждого биотопа берут не менее 100 экземпляров. Для более точного определения степени инвазированности моллюсков гельминтами исследуют из каждого биотопа 300-400 экземпляров. Этот моллюск имеет коническую тонкостенную раковину серовато-желтого цвета с 5-6 выпуклыми оборотами. Устье моллюска яйцевидное, высота раковины—до 10 мм. Моллюска исследуют полностью или отрезают верхушку раковины, где расположена печень с развивающимися в ней личинками: спороцистами, редиями и церкариями.
Спороциста — первая стадия партеногенетического развития трематод. Образуется она чаще в печени моллюска из проникшего в него мирацидия. Спороцисты трематод бывают различны по форме, у фасциол они веретенообразной формы с закругленными концами. Стенки их тонкие, пищеварительной системы нет, внутри они заполнены клетками. При оптимальных условиях развития внутри спороцисты уже на 8-й день появляются редии. Спороцисты без редий обнаружить трудно, так как они небольшие по размеру (0,1—0,2 мм) и неподвижны.
|
|
|
Редия является второй стадией партеногенетического поколения трематод. После созревания в спороцисте редии разрывают ее оболочку и находятся в основном в печени. Форма тела у редий сигарообразная. Они имеют ротовое отверстие, глотку, кишечник, а также выделительную систему. Сформировавшиеся молодые редии фасциол имеют длину до 0,47 мм, 13-дневные—0,63мм, 19-дневные—до 1,5мм. Внутри молодых редий находятся зародышевые клетки, из которых затем вырастают или дочерние редии, или церкарии. При благоприятных погодных условиях церкарии могут обнаруживаться уже в 24-дневных редиях. Молодых редий фасциол, как и спороцист, нельзя дифференцировать от редий других трематод.
Церкарии после созревания выходят из редий через «родильное отверстие». В зрелом возрасте церкарии фасциолы обыкновенной молочного цвета. Он состоит из двух обособленных отделов —переднего (овального) и заднего — хвостового придатка. Тело церкария размером 0,22—0,35х0,17—0,22 мм имеет ротовую и брюшную присоски, глотку, кишечник и цистогенные железы. Длина хвоста церкария 0,25—0,55 мм. После пребывания в воде 30—40 минут хвосты у церкариев отпадают и они превращаются в адолескариев. Несмотря на то, что отдельные виды трематод развиваются только в моллюсках определенных видов, многие моллюски являются промежуточными хозяевами одновременно для ряда трематод. В связи с этим в них могут быть обнаружены разные церкарии, которых необходимо отличать друг от друга по характерным морфологическим признакам.
Исследование катушек планорбид проводится с целью обнаружения в них личинок парамфистоматид. Установлено, что в хозяйствах Беларуси промежуточными хозяевами парамфистоматид являются моллюски Р1аnоrbis planorbis, Аnisus vоrtех и др. Они находятся в мелиоративных каналах, в небольших водоемах, богатых травянистой растительностью с дерново-глеевыми и пе-регнойно-иловато-глеевыми почвами (рН 5,2—5,5). Плотность их составляет от единичных экземпляров до 75 (и более) на 1 м2 поверхности биотопа.
|
|
|
Катушек исследуют с помощью компрессория. При этом личинок парамфистоматид можно обнаружить как в самом моллюске, так и в жидкости, вытекающей при раздавливании их между стеклами компрессория. С апреля до первой половины июля обычно проводят исследование взрослых перезимовавших моллюсков, так как в молодых моллюсках церкариев парамфистоматид можно обнаружить лишь с середины июля до октября. Из одного биотопа вскрывают и исследуют не менее 100—200 моллюсков. В катушках можно обнаружить церкарии различных трематод, поэтому церкариев парамфистоматид необходимо уметь отличать от остальных гельминтов.
Церкарии парамфистоматид темно-коричневого цвета, тело овальной формы, сплющенное, размером 0,21-0,45х0,17-0,30 мм. Передний конец тела оттянут и притуплен, задний более широкий и закруглен. На переднем конце личинки располагается фаринкс, по бокам основания которого находятся два черных глазка треугольной формы. В месте прикрепления к телу хвоста располагается брюшная присоска круглой формы. Длина хвоста составляет 0,59—0,75 мм.
Наземные моллюски исследуются с целью обнаружения в них личинок дикроцелий, эуритрем, протостронгилид и др. На территории европейской части России промежуточными хозяевами для дикроцелий (D. lаnсеаtum) являются следующие виды моллюсков семейства Неlicidае: Неliсеlla саndicans, Неlicopsis instabilis, Monacha cartusiana, Моnасhа truticicola, Рsеudotrichia rubidinosa, Enomphalia strigella и др., а также некоторые моллюски семейств Вгаgуbаеnidае, Сосhlicopidaе, Zonitidae, Gimacidaе, Еnidае и др.
Инвазированность мелких моллюсков личинками дикроцелиев определяют при раздавливании их между стеклами и микроскопированием препаратов. Крупных моллюсков исследуют после освобождения их от раковин и извлечения пищеварительной железы. Последнюю помещают в каплю воды на предметное стекло, измельчают и микроскопируют. При этом необходимо обнаружить материнские и дочерние спороцисты или церкарии. Последние представляют собой овально-удлиненной формы личинку с длинным хвостом. Зрелых церкариев обнаруживают в моллюсках чаще в весенне-летний период.
|
|
|
В моллюсках церкарии проникают в их дыхательную полость, покрываются клейким слизистым веществом, образуя слизистые комочки, в которых содержится до 200 церкариев и более. Из тела моллюска слизистые комочки выталкиваются и прилипают к растениям.
Муравьи находят слизистые комочки с церкариями дикроцелий и охотно их поедают. В теле муравья церкарии мигрируют в его брюшную полость, покрываются цистой и превращаются в метацеркариев. Для заражения животных дикроцелиями необходимо, чтобы муравьи с метацеркариями этих гельминтов попали в организм. В связи с этим для гельминтологической оценки пастбищ на дикроцелиоз необходимо провести исследование муравьев. Для этого отыскивают и устанавливают зараженность не всех собранных муравьев, а только тех, которые находятся в состоянии «оцепенения». Насекомых помещают в пробирку и на 3-5 минут кладут туда ватный тампон, смоченный эфиром. Затем на предметном стекле препаровальными иглами у муравьев вскрывают брюшко и просматривают под микроскопом или лупой на наличие метацеркариев. Они бывают видны заключенными в цисту длиной 0,28—0,4 и шириной 0,2—0,26 мм. В одном муравье может находиться от единичных до 350 метацеркариев и более.
Исследования панцирных клещей из родов Schelozibates, Zygoribatula, Сеrаtozetеs и др. проводятся с целью обнаружения личинок мониезий и других цестод из семейства Акантоцефалид. Для этого берут поверхностный слой почвы и с помощью аппарата Тульгрена выделяют орибатид. Клеща помещают на предметное стекло в каплю воды, панцирь его расщепляют иглами, покрывают покровным стеклом и микроскопируют. Цистицеркоид мониезий представляет собой шаровидное образование диаметром 0,16—0,20 мм, в центре которого находится сколекс с присосками.
Обследование объектов внешней среды для обнаружения клещей и паразитических насекомых
Обследование пастбищ для обнаружения иксодовых клещей. На деревянный стержень длиной 100 см прикрепляют кусок марли или ткани размером 60х80 см и медленно обеими сторонами проводят по траве или мелкому кустарнику обследуемого пастбища. После этого марлю или ткань осматривают и собирают клещей.
Для сбора иксодовых клещей можно пользоваться также специальным экраном, представляющим собой легкую деревянную раму размером 180-200х80-100 см. С одной стороны раму затягивают белой бязью, разграфленной на восемь - десять поперечных полос на равном расстоянии одна от другой. Один человек проносит экран в вертикальном положении через заросли, второй наблюдает за экраном и снимает прикрепившихся к нему клещей, которых затем исследуют или консервируют.
|
|
|
Исследование иксодовых клещей на наличие пироплазматид проводят по методу А. А. Цапруна и А. А. Маркова. Отбирают самок клещей, умерщвляют их хлороформом или эфиром, затем проводят через 96°-ный этиловый спирт. В чашку Петри, дно которой покрыто парафином, наливают физиологический раствор и переносят туда клещей. С помощью ножниц отсекают задний край брюшка клеща, а затем разрезают наружные края брюшка. После этого клеща прикрепляют к парафину тонкими булавками, препаровальной иглой приподнимают задний край его хитиновой покрышки, пинцетом отводят ее вперед и отсекают ее у основания хоботка.
По бокам передней части тела клеща располагаются слюнные железы, их отделяют от трахей, жирового тела и органа Жанэ, помещают на обезжиренное предметное стекло в каплю воды и размельчают препаровальной иглой до получения мелкой суспензии. Из нее готовят тонкий мазок, тщательно его высушивают (в термостате при 37 °С в течение 3 ч, при комнатной температуре — 12ч) и фиксируют метиловым спиртом 10 минут. Окраску мазков проводят по Романовскому-Гимза или по Нохту.
При микроскопировании препаратов пироплазматид находят в виде образований овальной, округлой, грушевидной или червеобразной формы, в которых хорошо видны ядро и протоплазма.
Исследование гемолимфы иксодовых клещей для обнаружения пироплазматид проводят по методу И. В. Абрамова. Для этого самку клеща обмывают дистиллированной водой и высушивают фильтровальной бумагой. Затем ножницами отрезают одну конечность. При этом выступает капелька гемолимфы, которую наносят на обезжиренное предметное стекло и делают мазок. Его высушивают, фиксируют 10 минут метиловым спиртом, красят по Романовскому-Гимза и микроскопируют с использованием иммерсионной системы.
Методы обнаружения аргасовых и гамазовых клещей. Для обнаружения аргасовых и гамазовых клещей в птичниках собирают остатки сухого корма, пыль из трещин в банки с притертыми пробками. После этого небольшими порциями собранный материал помещают на чашку Петри и подогревают на спиртовке. Выползших клещей собирают влажной кисточкой и микроскопируют.
Для обнаружения клещей можно применять и метод флотации. С этой целью небольшое количество сора из птичника или из гнезда (5—10 г) помещают в стеклянный цилиндр емкостью 200 мл, заливают водой, тщательно перемешивают и отстаивают. С поверхности удаляют всплывшие посторонние частицы, воду осторожно сливают, а осадок помещают в пробирку и центрифугируют при 1500 об/мин 1—2 минуты. Жидкость из пробирки сливают, а осадок микроскопируют.
Сбор орибатидных клещей. Применение аппарата Тульгрена для сбора орибатидных клещей. Вначале собирают аппарат Тульгрена. Для этого берут крупную стеклянную воронку, к узкому концу которой с помощью резиновой трубки прикрепляют пробирку. Раструб воронки затягивают марлей или покрывают металлической сеткой с мелкими отверстиями.
На марлю или сетку помещают исследуемый материал (пробу травы, почвы, мха и др.). Аппарат укрепляют в штативе и на расстоянии 20—25 см от пробы материала помещают электролампу мощностью 100 Вт, постоянно освещающую пробу. В результате подсыхания и под действием света орибатидные клещи выползают из исследуемой пробы, проваливаются через отверстия марли или сетки и попадают в пробирку. Через 1—2 суток пробирку снимают, а клещей помещают на предметное стекло и микроскопируют.
Метод С. Н. Никольского. Почву или дерн размером 10х10х2 см после тщательного измельчения просеивают через ряд сит. Наиболее мелкую часть отсева насыпают тонким слоем в часовые стекла, которые перед этим ставят в наполненные водой чашки Петри и в таком виде выставляют на хорошо освещенные подоконники. Под влиянием света орибатидные клещи выползают на край часовых стекол и сваливаются в воду, из которой их извлекают акварельными кисточками, помещают на предметное стекло и микроскопируют.
Сбор паразитических насекомых в помещениях и на пастбищах. Мух-жигалок вылавливают с помощью пробирок, энтомологических сачков или мухоловок. В помещениях они встречаются на протяжении всего лета, но больше всего в августе и сентябре.
Мухи других видов чаще встречаются в летнее время возле животноводческих помещений, навозохранилищ, мусорных ям и т. д. Они предпочитают теплые и освещенные поверхности. После отлова мух умерщвляют в морилке, накалывают на энтомологические булавки или же помещают в склянки с притертой пробкой, куда перед этим наливают 70°-ный этиловый спирт.
Комаров в помещениях отлавливают в различных затемненных местах, а также на окнах, стенах, потолках. Зимой их можно обнаружить в теплых подвалах, погребах, животноводческих помещениях. Их отлавливают с помощью пробирки, после чего помещают в нее ватный тампон, смоченный хлороформом или эфиром.
На пастбищах насекомых отлавливают с помощью энтомологического сачка, который представляет собой мешок длиной 75—100 см, натянутый на обод диаметром 30—35 см и укрепленный на деревянную палку длиной 1,2—1,5 м. Мешок обычно делают из марли.
Энтомологическим сачком кроме мух и комаров отлавливают также слепней. Их обычно находят в местах, заросших кустарником или тростником, возле водоемов, на опушках леса. Отлов их производят также возле животноводческих помещений или летних лагерей для животных.
Следует учитывать, что лет слепней наблюдается с конца мая до августа — сентября при температуре воздуха более 15°С. Особенно интенсивным лет слепней бывает в жаркие и безветренные дни. Умерщвленных в морилке слепней помещают в бумажные коробочки и в дальнейшем высушивают. Применять для консервации слепней спирт, эфир, хлороформ или другие жидкости не следует, так как потом невозможно определить их вид.
Оводов подкожных и желудочных также можно отлавливать с июня до сентября энтомологическим сачком в теплые безветренные дни, когда температура достигает 16—18°С и более. Полостных оводов овец собирают утром руками с помощью ловчего цилиндра или пробирками на стенах животноводческих помещений, на ограде или скирдах сена в безветренную солнечную погоду.
Личинок полостных оводов различных стадий развития можно извлечь из носовой полости животного с помощью различных лекарственных веществ. Для этой цели можно применять также марлевые тампоны, пропитанные смесью лизола и глицерина (1:50). Тампоны прикрепляют к эластичному пищеводному зонду и вводят в глубь носовой полости, проводя легкие продольные и круговые движения им. Некоторые личинки на тампоне оседают и их извлекают из носовой полости животного.
СОСТОЯНИЕ ИММУНИТЕТА И ОБМЕННЫХ ПРОЦЕССОВ ПРИ ВИРУСНЫХ РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ИНФЕКЦИЯХ ТЕЛЯТ
В процессе эволюции в легких сформировались два наиболее важных компонента, один из которых обеспечивает поступление воздуха и газообмен, а другой — защитные и иммунные функции. В альвеолярных образованиях, имеющих большую суммарную поверхность, происходит газообмен при контакте вдыхаемого воздуха с кровью. Слизистая оболочка, выстилающая дыхательные пути, клетки, секретирующие слизь, реснитчатые и другие образования, бактерицидные факторы осуществляют первый барьер защиты от многочисленных воздействий воздушной среды. Лимфоидная ткань, ассоциированная с легкими, реагирует на антигенное воздействие реакциями гуморального и клеточного иммунитета.
У здоровых животных в легочной ткани из факторов иммунной защиты важную роль играют ферменты, лизоцим, альвеолярные макрофаги, лимфоциты и лимфоидная ткань, секреторные антитела, бактерицидные факторы. Но при проникновении возбудителей вирусной и бактериальной природы этот гомеостаз нарушается. При этом проявляются дефекты альвеолярных макрофагов, усиливается секреция лимфоцитами Ig A, Ig G, Ig M, образуются иммунные комплексы, которые вызывают локальные изменения микроциркуляции кровообращения, изменения вязкости крови, увеличивают температуру ткани, их отечность, включая другие иммунологические повреждения, в том числе аллергические реакции.
При инфекционных заболеваниях наряду с местным нарушением иммунитета в легочной ткани происходит и изменение иммунитета всего организма в целом. Иммунология вирусных респираторных инфекций к.р.с. имеет свои особенности, которые изучались многими исследователями в ряде стран мира.
При вирусных респираторных заболеваниях взаимодействие вирусов и клеток иммунной системы идет по двум направлениям. Во-первых, вирусы-возбудители этих заболеваний выступают в качестве антигенного стимулятора защитных иммунологических реакций; во-вторых (что отмечается чаще), вирус вызывает иммунодепрессию, т.е. снижает иммунологическую реактивность.
При экспериментальном заражении или естественном переболевании крупного рогатого скота инфекционным ринотрахеитом, вирусной диареей, парагриппом-3, респираторно-синцитиальной, адено-, рота-, корона- и парвовирусными инфекциями или их ассоциациями организм животных отвечает иммунными реакциями — гуморальными или клеточными.
При этом у телят вырабатываются антитела различных классов, и происходит перестройка клеточного иммунитета: активизируются Т- и В-системы лимфоцитов, система мононуклеарных макрофагов.
После 5 мес. стельности плод крупного рогатого скота может вырабатывать антитела, относящиеся к Ig M и Ig G, но в сыворотках плодов редко встречаются вирусспецифические антитела. После рождения в оптимальном случае в течение первых 12 часов происходит ресорбция антител молозива, которая заканчивается в течение 36 часов. Полученные таким образом антитела могут сохраняться в организме до 3-месячного возраста.
При инфекционном ринотрахеите значительное внимание уделяется секреторному Ig A-класса, накапливающемуся и вырабатывающемуся в дыхательных и половых путях. Такие антитела обеспечивают защиту путем нейтрализации повторно инфицирующих вирусов, но не могут опосредовать прямое уничтожение инфицированных вирусом клеток. Выздоровление и повторное заражение инфекционным ринотрахеитом коррелирует с потерей и повторным приобретением секреторных антител Ig A-класса, несмотря на присутствие сывороточных вируснейтрализующих антител.
Изучение гуморального иммунитета при вирусной диарее изучали S.R.Bolin и R.O.Donis et al. Ими изучена молекулярная специфика иммунного ответа на гликопротеины вируса диареи. При этом установлено, что специфические Ig G-антитела, индуцированные у коров, естественно или экспериментально инфицированных вирусной диареей, оказались практически одинаковыми. Высокий Ig G — ответ был на 2 гликопротеина (56—58 КД и 48 КД). На другие гликопротеины (118 КД, 80 КД, 37 КД) иммунный ответ был неодинаковым у разных животных.
Респираторно-синцитиальный вирус вызывает заболевание как при наличии, так и при отсутствии в крови антител. Защитную роль против этой болезни выполняют главным образом антитела носовых секретов. Наряду с гуморальным иммунным ответом в защите против респираторно-синцитиальной инфекции значительную роль играет и клеточный иммунитет.
L.A.Babink, B.T.Rouse, изучая клеточные защитные механизмы при инфекционном ринотрахеите, выявили стимуляцию функции вирус-специфичных лимфоцитов и показали прямое уничтожение инфицированных вирусом клеток посредством Т-клеток. Иммунные лимфоциты периферической крови могут взаимодействовать с инфицированными вирусом клетками и таким образом предупреждать распространение вируса от клетки к клетке. При сдерживании вирусной инфекции имеет место прямое уничтожение инфицированных вирусом инфекционного ринотрахеита клеток или выделение интерферона Т-лимфоцитами в результате вирусной стимуляции. Клеточный иммунитет может также проявляться в форме задержки реакции гиперчувствительности при кожной пробе у инфицированных вирусом инфекционного ринотрахеита животных. Эта проба является достоверным показателем иммунного состояния инфицированных вирусом животных и приемлема для выявления вирусоносительства и животных с латентной инфекцией, у которых отсутствуют нейтрализующие антитела.
G.Bronnlie et al. при экспериментальном заражении телят двумя штаммами вируса диареи (цитопатогенным и нецитопатогенным) не установили существенной разницы в иммунном ответе в течение 2—3 недель. При этом изучалась функциональная активность Т-лимфоцитов под действием фитогемагглютинина, количественные показатели В- системы лимфоцитов.
При респираторно-синцитиальной инфекции в иммунном ответе особое значение имеет Т-система лимфоцитов, которая является одним из основных защитных механизмов организма.
Но при изучении иммунитета у крупного рогатого скота при вирусных респираторных инфекциях наряду с нормальным иммунным ответом чаще всего отмечают иммунодефициты или иммунодепрессию. Иммунодепрессия возникает непосредственно из-за патогенетического действия вирусов, в частности, ввиду их вирулентности, способности репродуцироваться в клетках иммунной системы (лимфоциты, макрофаги), а также возможности вызывать иммунологическую толерантность и др.
В мировой литературе накопилось немало данных, свидетельствующих об иммунодепрессивном действии вирусов, и в том числе вирусов-возбудителей респираторных инфекций к.р.с.
В иммунопатологии крупного рогатого скота особую роль играет вирус диареи. При вирусной диарее иммунопатология имеет место как в пренатальном, так и в постнатальном периодах развития животных.
В пренатальном развитии имеет значение иммунологическая толерантность. Толерантность возникает при введении вируса диареи в плоды сероположительных или сероотрицательных стельных коров в период 58—125 дней стельности, а также внутривенно серонегативным животным со сроком стельности 42—114 дней. В результате от коров получают клинически здоровых телят, персистентно инфицированных вирусом. Повторное заражение этих телят вирусом диареи не вызывает выработки нейтрализующих антител. В то же время животные оставались иммунокомпетентными в отношении других инфекционных агентов — вирусов ИРТ или ПГ-3.
По данным M.Bielefeld-Ohmann, наряду с иммунотолерантностью, иммунодепрессия включает угнетение пролиферации лимфоцитов, продукции антител, миграции моноцитов и активности нейтрофилов. Заражение вирусом диареи телят при наличии у них виремии приводит к блокированию Т- и В-лимфоцитов, моноцитов и клеток периферической крови. У хронически инфицированного крупного рогатого скота отмечается снижение процентного содержания Т- и В-лимфоцитов, нулевых клеток. В этих клетках, а также в моноцитах и нейтрофилах репродуцируется вирус диареи.
Через 5—7 дней после внутривенной инокуляции вируса диареи развиваются клинические признаки, снижается абсолютное количество Т- и В-лимфоцитов и процентное отношение Т-лимфоцитов в периферической крови. Это явление наблюдается в течение 7 дней. Характерной особенностью течения вирусной диареи является повышенное содержание и активность Т-супрессоров.
Изучение пролиферативной активности лимфоцитов при вирусной диарее показало, что синтез ДНК лимфоцитов, полученных от больных телят в присутствии конканавалина А и фитогемагглютинина снижалось на 41—99%, титр антител был низкий — 1:8 или вообще отсутствовал. Также отмечалось ослабление способности лейкоцитов к перевариванию золотистого стафилококка. Наряду с поражением клеток иммунитета при вирусной диарее, при летальном исходе болезни количество Ig G было значительно ниже по сравнению со здоровыми животными.
Вирус инфекционного ринотрахеита также в некоторой степени обладает иммунодепрессивными свойствами. Так, E.K.Nafi et al. при изучении электрофоретического профиля сывороточных протеинов при естественном инфицировании вирусом инфекционного ринотрахеита отмечают значительное повышение альфа-1-глобулинов в группе лихорадящих животных, но наивысший уровень альфа-1 и альфа-2 глобулинов был у выздоравливающих. Концентрация бета-1, бета-2 и гамма-глобулинов была значительно понижена у выздоравливающих телят, а у больных и лихорадящих эти фракции отсутствовали, что свидетельствует о состоянии иммунной системы при указанной болезни. При инфекционном ринотрахеите состояние подавления иммунитета часто наблюдается у коров во время стельности или под влиянием стрессовых ситуаций.
Характерной особенностью инфекционного ринотрахеита является способность вызывать аллергию немедленного и замедленного типа. У иммунных животных, которым вводили внутривенно высокие дозы вируса, наблюдались аллергические реакции немедленного типа, приводивших к гибели от острого или затянувшегося шока. Наиболее тяжелые реакции были отмечены у животных, предварительно иммунизированных путем внутривенных инъекций. Об аллергии свидетельствует также то обстоятельство, что эти реакции у животных можно было бы воспроизводить повторно. У животных, у которых были отмечены аллергические реакции, резко снижалось содержание лейкоцитов, тогда как титр вируснейтрализующих антител во время проявления реакций изменялся незначительно.
Характерным для инфекционного ринотрахеита является также и то, что при персистентном течении заболевания активизируется вирусовыделение при обработке животных иммуносупрессивными препаратами. При этом вирус выделяется из респираторных путей, гениталий, а также из головного мозга, хотя животные инфицируются путем внутривлагалищного введения вируса. Вирус инфекционного ринотрахеита вызывает у зараженных животных лихорадку, увеличение титра нейтрализующих антител свыше 1:256. Возникает значительное снижение общего числа элементов белой крови и числа мононуклеаров. Отмечено понижение степени миграции нейтрофилов и повышения активности переваривания золотистого стафилококка. Указанный вирус индуцирует изменение функции нейтрофилов, что может служить предрасполагающим условием для возникновения бактериальных пневмоний, часто сопровождающих инфекционный инотрахеит. Исследованиями T.T.Brown et al. установлено, что у альвеолярных макрофагов снижено количество поверхностных рецепторов Fc и C3b, ослаблена способность фагоцитировать опсонизированный эпидермальный стафилококк.
Широкое распространение пневмоэнтеритов среди молодняка к.р.с. в животноводческих хозяйствах Беларуси и других стран СНГ наносит большой экономический ущерб как вследствие падежа, так и снижения привесов, затрат на лечение больных животных и т.д.
Как было указано выше, переболевание телят пневмоэнтеритами сопровождается значительными изменениями в иммунной системе, состоянии обмена веществ. Для изучения данного вопроса нами были обследованы телята возрастом 2—3 мес. различного клинического состояния — больные респираторными заболеваниями, переболевшие и клинически здоровые. Всего обследовано по 15—20 голов в каждой группе. Состояние иммунитета изучали по 25 показателям, состояние обмена веществ — по 23.
В табл. 34 и на рис. 1 и 2 представлены данные о состоянии клеточного иммунитета у телят различного клинического состояния при пневмоэнтеритах.
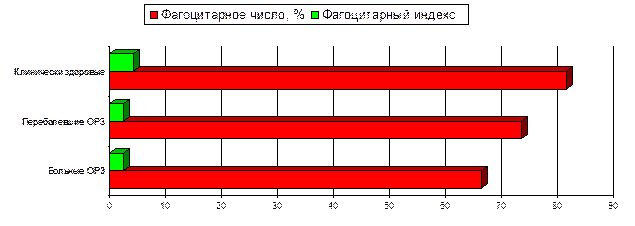
Рисунок 1. Показатели клеточного иммунитета у телят различного клинического состояния при пневмоэнтеритах

Рисунок 2. Показатели клеточного иммунитета у телят различного клинического состояния при пневмоэнтеритах
Из представленных результатов по изучению клеточного иммунитета у телят различного клинического состояния видно, что при переболевании отмечаются значительные изменения в клеточном иммунитете. Наиболее характерным является уменьшение Т‑лимфоцитов, фагоцитарной активности нейтрофилов, менее характерным — уменьшение В‑лимфоцитов. Так, у больных пневмоэнтеритами телят процентное содержание Т‑лимфоцитов в 1,2 раза ниже, чем у клинически здоровых телят, а у переболевших — в 1,04 раза. У больных и переболевших пневмоэнтеритами телят процентное содержание В‑лимфоцитов в 1,28 раза меньше, чем у здоровых. Фагоцитарное число у больных телят в 1,23 раза меньше, чем у здоровых, а у переболевших — в 1,11 раза. Фагоцитарный индекс — соответственно в 1,56 и 1,76 раза. Но у больных пневмоэнтеритами телят общее количество лейкоцитов выше, чем у переболевших и здоровых — соответственно в 1,44 и 1,12 раза. Процентное содержание лимфоцитов у больных телят на 3% ниже, чем у клинически здоровых, но на 7,3% выше, чем у переболевших.
Таблица 34
|
|
|


